Kohlendioxid als vielseitiges Fluid
Kohlenstoffdioxid (CO2) hat ein zwiespältiges Image. In der Öffentlichkeit wird es oft als kritisch angesehen, da es als klimaschädliches Treibhausgas gilt. Nicht nur kritisch, sondern überkritisch bezeichnet hingegen einen besonderen Aggregatzustand, der den Stoff in ein besseres Licht zu rücken vermag. Überkritisches CO2 wird oft auch superkritisches CO2 (scCO2) genannt – und überkritische Fluide haben einige vielversprechende Eigenschaften. Damit verbunden sind wichtige Anwendungsmöglichkeiten in Chemie und Technik.
Das Phasendiagramm – Wichtiges Tool für Ingenieure und Wissenschaftler
Was sind überkritische Fluide? Um dies zu beantworten, lohnt sich zunächst ein Blick auf ein typisches Phasendiagramm.
Ein Phasendiagramm veranschaulicht, unter welchen Bedingungen verschiedene Phasen existieren und wo Phasenübergänge auftreten. Dabei ergeben sich Linien, die die Grenzen zwischen zwei Phasen verdeutlichen.
Auf diesen Koexistenzlinien stehen die beiden benachbarten Phasen im Gleichgewicht, da der Stoff dort als einzelne Phase nicht stabil ist. Dabei wird die Koexistenzlinie flüssig/gasförmig als Siedekurve bezeichnet, während die Sublimationskurve die Grenze fest/gasförmig beschreibt. Die Koexistenzlinie fest/flüssig wird als Schmelzkurve definiert und weist als einzige keinen Endpunkt auf.
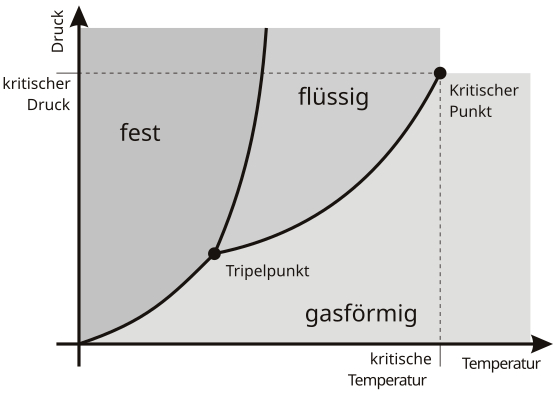
Im Phasendiagramm gibt es besondere Koexistenzlinien, die als Extremwert einen sogenannten kritischen Punkt beinhalten und als Binodale bezeichnet werden. Eine solche Binodale ist zum Beispiel als Siedekurve zwischen dem Tripelpunkt und dem kritischen Punkt zu sehen. Doch was ist so besonders am Tripelpunkt und dem kritischen Punkt?
Der Tripelpunkt
Neben den Koexistenzlinien, bei denen nur zwei Phasen im Gleichgewicht stehen, gibt es einen Punkt, bei dem sich die Schmelz-, Siede-, und Sublimationskurven schneiden. Dort stehen drei Aggregatszustände im Gleichgewicht, wodurch es nicht mehr möglich ist, zwischen den Zuständen zu unterscheiden. Dieses Druck-Temperatur-Paar wird Tripelpunkt (auch Dreiphasenpunkt) genannt.
Der Tripelpunkt von Wasser beispielsweise liegt bei +0,01 °C und 6 mbar und wird gerne zum Kalibrieren von Thermometern verwendet. Bei Kohlendioxid ist der Tripelpunkt bei -56,6 °C und 5,18 bar.
Der kritische Punkt
Ein weiteres wichtiges Druck-Temperatur-Paar im Phasendiagramm ist der kritische Punkt am Ende der Siedekurve. Hier ist es nicht mehr möglich, zwischen Flüssigkeit und Gas zu unterscheiden. Bei Wasser beispielsweise liegt die kritische Temperatur bei +374 °C und der kritische Druck bei 221 bar. Im Fall von Kohlendioxid ist der kritische Punkt bei +31 °C und 74 bar.
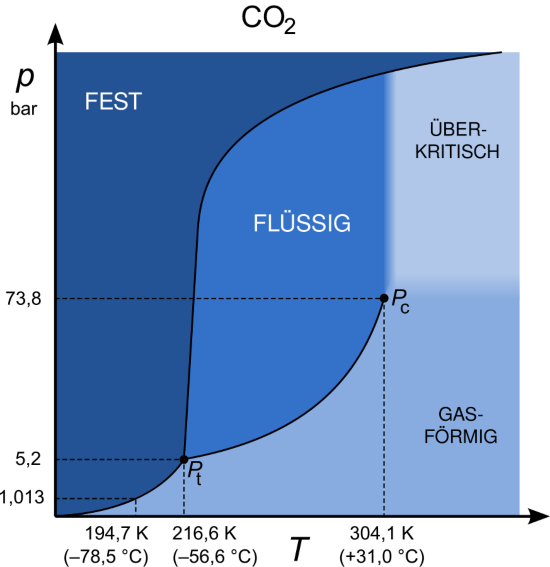
Ein überkritischer Zustand wird erreicht, wenn am kritischen Punkt der Druck und die Temperatur weiter erhöht werden. Solche überkritischen Fluide vereinen bestimmte Eigenschaften von Flüssigkeiten und Gasen. Daraus ergeben sich einige Vorteile gegenüber den jeweiligen Reinphasen und anderen Stoffen. Kohlenstoffdioxid zählt zu den bekanntesten Substanzen, die im überkritischen Zustand interessante Anwendungen mit sich bringen.
Was ist überkritisches CO2?
Unter Standardbedingungen ist Kohlendioxid zunächst ein farbloses Gas und mit 0,04 % ein natürlicher Bestandteil der Luft. Es entsteht bei der Zellatmung, bei Verbrennungsprozessen oder wird aus dem Erdreich freigesetzt. Atmosphärisches Kohlendioxid wird innerhalb des Kohlenstoffkreislaufs durch Photosynthese abgebaut oder etwa in Gewässern physikalisch gespeichert. Kohlendioxid ist als Treibhausgas bekannt, das zum natürlichen Treibhauseffekt auf der Erde beiträgt.
In seinem überkritischen Zustand, wenn also Druck und Temperatur über dem kritischen Punkt liegen, hat CO2 eine flüssigkeitsähnlich hohe Dichte, einen hohen Diffusionskoeffizienten und eine geringe Viskosität. Der Stoff ist außerdem ungiftig, nicht brennbar, leicht verfügbar und kostengünstig. Diese Eigenschaften bilden die Basis für zahlreiche Einsatzmöglichkeiten, bei denen scCO2 Vorteile gegenüber den klassisch verwendeten Substanzen haben kann.
Extraktion mit überkritischem CO2
Extraktionen sind Verfahren, bei denen ein Stoff mithilfe eines Lösungsmittels aus einem Gemisch isoliert wird. Dabei muss sich der jeweilige Stoff besser im eingesetzten Lösungsmittel lösen als im ursprünglichen Stoffgemisch. Extraktionsverfahren sind vor allem in der chemischen Industrie bedeutsam, wo Ausgangsstoffe für verschiedenste Produkte gewonnen werden können.
Es lässt sich auch rückstandslos vom jeweiligen Produkt entfernen. Außerdem wird die thermische Belastung der Extrakte durch die moderaten Temperaturen relativ geringgehalten.
Deshalb wird das Fluid eingesetzt, um Naturstoffe, Gewürze und Aromen, Fette und Öle sowie Farbstoffe schonend zu gewinnen. Dazu zählen auch Extraktionsverfahren, um unerwünschte Stoffe aus Produkten zu entfernen – beispielsweise Koffein in Kaffeebohnen, Harze im Hopfen oder Nikotin im Tabak. Superkritisches Kohlendioxid wird insbesondere bevorzugt als Lösungsmittel verwendet, wo hohe Standards der Produktqualität eingehalten werden müssen. Entsprechend wird es oft in Kosmetik, Pharmazie, Medizintechnik sowie der Lebensmittel- und Getränkeindustrie eingesetzt.
Superkritisches CO2 hat jedoch den Nachteil, dass viele polare Stoffe wie etwa Zucker nicht extrahiert werden können, da der Stoff unpolar ist. Auch bei bestimmten schwerlöslichen Substanzen stößt scCO2 an seine Grenzen. Außerdem müssen teils besondere Anforderungen an die Apparaturen gestellt werden, um die Betriebsbedingungen für den superkritischen Zustand einzuhalten.
Wie funktioniert die Extraktion mit überkritischem CO2?
CO2 wird in zunächst flüssiger Form unterkühlt, anschließend unter hohem Druck erwärmt und in den überkritischen Zustand gebracht und anschließend in das Ausgangsmaterial überführt. Dabei können die Lösungseigenschaften durch Änderung von Druck und Temperatur verändert und angepasst werden. Sobald die jeweiligen Stoffe vom Rohmaterial gelöst sind, wird der Druck wieder unterhalb des kritischen Drucks gefahren. Das gasförmige CO2 verflüchtigt sich, die gelösten Stoffe werden wieder freigesetzt und es ergibt einen Extrakt.

Zu den wirtschaftlich wichtigen Beispielen für die superkritische CO2 Extraktion gilt die Entkoffeinierung von Kaffee und Tee. Auch bei der Bierherstellung spielt superkritisches Kohlendioxid eine Rolle. Hier werden bestimmte Säuren extrahiert, wodurch sich der Geschmack gezielt steuern lässt. Im Bereich der Medizin und Kosmetik wird ähnlich selektiv extrahiert, wodurch beispielsweise Allergene entfernt werden können. Vielfach handelt es sich dabei um etablierte Verfahren im großtechnischen Maßstab.
Neben ihrer primären Rolle als Lösungsmittel bei Extraktionsverfahren haben überkritische Fluide wie scCO2 weitere interessante Einsatzmöglichkeiten, die bislang mehr oder weniger gut erforscht oder etabliert sind.
Anwendungsbeispiele
Überkritische Fluide im Recycling
Überkritische Fluide sind im Bereich des Recyclings vielversprechend und ihre Anwendungsbereiche wachsen stetig. Beispielsweise können damit verunreinigte Kunststoffe aufbereitet werden, wie etwa gebrauchte Benzin- oder Öltanks. Auch beschichtete Kunststofffolien lassen sich mithilfe von superkritischem Kohlendioxid wiederverwerten. Dabei können Tinte wie auch Kleb- und Schadstoffe von gebrauchten Folien abgetrennt werden. Außerdem kann superkritisches CO2 eingesetzt werden, um Edelmetalle oder seltene Erden aus Elektroschrott zu gewinnen.
Mischkunststoffe sind nur sehr aufwendig aufzutrennen, weshalb diese oft verbrannt werden. In diesem Zusammenhang wird überkritisches Wasser als Lösung für das Recyceln von Kunststoffmüll in Betracht gezogen. Das überkritische Fluid soll dabei helfen, Kunststoffe aus Folien oder Verpackungen aufzubereiten und Granulate für neue Kunststoffe herzustellen.
scCO2 bei Beschichtungen
Überkritisches Kohlendioxid kann genutzt werden, um Kunststoffe wie Polypropylen, Polycarbonat, Nylon oder auch Kontaktlinsen schnell und günstig einzufärben – und das ganz ohne umwelt- und gesundheitsschädliche Lösungsmittel. Das scCO2 öffnet dabei die Oberflächenstruktur der Kunststoffe und bringt die gelösten Farbstoffe in die Oberfläche ein. Diese werden nach Reduzierung des Drucks dann an der Oberfläche abgeschieden.
Solche Verfahren könnten eine Alternative für klassische Lackierungen einschließlich der verwendeten Lösungsmitteln darstellen. Das reine Lackieren kann auch auf andere Beschichtungen erweitert werden. So ist es möglich, Oberflächen mit Nanopartikeln zu beschichten oder zu imprägnieren, was Potenzial im Bereich antibakterieller Beschichtungen wie bei Türklinken oder interaktiven Bedienelementen hat. In Krankenhäusern und Laboren könnte dies von großer Bedeutung sein.
scCO2 als Kühlmittel
Überkritisches Kohlenstoffdioxid wird als Kühlmittel in der Medizintechnik eingesetzt, wie zum Beispiel beim Fräsen von Polyethylen für Implantate. In Wärmepumpen oder Kälteanlagen kommt die Substanz ebenfalls als Kältemittel zum Einsatz. Durch die hohe Wärmeleitfähigkeit können dabei kleinere Bauteile verwendet werden als mit herkömmlichen Kältemitteln.
scCO2 bei der Stromerzeugung
Mit seinen besonderen physikalischen Eigenschaften ist superkritisches CO2 auch ein vielversprechender Stoff, um Strom nachhaltig zu erzeugen. Mit dem Fluid können statt den üblichen voluminösen Dampfturbinen deutlich kleinere und preiswertere Spezialturbinen mit hohem Wirkungsgrad verwendet werden.
scCO2 als Trocknungsmittel
Außerdem wird überkritisches Kohlenstoffdioxid als schonendes Trocknungsmittel verwendet, wo es empfindliche Materialien nicht beschädigt oder verformt. Dies ist zum Beispiel vorteilhaft bei der Herstellung von Aerogelen, der Trocknung von biologischen Proben für die Spektroskopie sowie bei der Mikrosystemtechnik.
scCO2 in weiteren Anwendungen
Überkritisches CO2 kann beim Reinigen von komplexen technischen Bauteilen eingesetzt werden, wo es als Lösungsmittel in kleine Hohlräume vordringen kann. So wird das Fluid beispielsweise für milde Sterilisationen in der Medizintechnik genutzt. Superkritisches CO2 kann auch als umweltfreundliches Schaummittel bei der Herstellung von Schaumstoffen nützlich sein, beispielsweise für Moosgummi oder Zellkautschukplatten. Nicht zuletzt wird Kohlendioxid in seinem superkritischen Zustand bei der Erdölförderung in Bohrlöchern verwendet.
Fazit
Unter hohen Temperaturen und Drücken zeigen Stoffe einen besonderen Aggregatszustand, den sogenannten überkritischen Zustand. Die physikalischen Eigenschaften von überkritischen Fluiden sind in vielerlei Hinsicht von großem Wert. Dabei ist dieser Zustand manchmal schon bei technisch gut umsetzbaren Bedingungen erreichbar, so wie beim CO2. Überkritisches CO2 ist darüber hinaus auch noch ungiftig und günstig. Ein Blick auf die zahlreichen und sicher noch nicht vollständig erschlossenen Anwendungsmöglichkeiten zeigt: CO2 ist ein wertvoller Rohstoff und kann einiges mehr als nur das Klima erwärmen.
Bildquellen: Beitragsbild | © fovito – stock.adobe.com Phasendiagramm eines Reinstoffs | © de:Benutzer:JoWi, Public domain, via Wikimedia Commons Phasendiagramm von Kohlenstoffdioxid (CO2) | © Rothwild, Public domain, via Wikimedia Commons Kohlenstoffdioxid am kritischen Punkt | © Bernhard Kuemel <bernhard@bksys.at>derivative work: Regi51, CC BY-SA 2.0 AT <https://creativecommons.org/licenses/by-sa/2.0/at/deed.en>, via Wikimedia Commons
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin






