Zu den grundlegenden Arbeitsaufgaben im chemischen Labor gehören das Herstellen von Lösungen sowie das Verdünnen von Lösungen. Unter einer Lösung versteht man das homogene Gemisch aus mindestens zwei Substanzen. Die Substanz mit dem Hauptanteil an der Lösung nennt man Lösungsmittel oder Lösemittel, diejenige mit einem geringeren Anteil wird als gelöster Stoff bezeichnet.
Polare Stoffe wie Salze, Zucker oder Harnstoff lösen sich bevorzugt in polaren Lösungsmitteln, während sich unpolare Stoffe wie Öle oder Wachs in unpolaren Lösemitteln lösen.
Wichtige Größen im chemischen Labor
Der Anteil des gelösten Stoffs an der Lösung wird durch die Konzentration abgegeben. Dabei unterscheidet man Massenkonzentration und Stoffmengenkonzentration. Die Einheit der Massenkonzentration ist g/l, die der Stoffmengenkonzentration mol/l. Gebräuchlich ist auch die Angabe Massenprozent, die Masse des gelösten Stoffs in g pro Gesamtmasse Lösung.
Was ist die „Löslichkeit“ eines Stoffes?
Ein weiterer Begriff im chemischen Labor ist die Löslichkeit. Nach dem „CRC Handbook of Chemistry and Physics” gibt die Löslichkeit die Stoffmasse einer Verbindung an, die sich bei einer bestimmten Temperatur in 100 g Wasser lösen lassen. Da die Löslichkeit einer Substanz temperaturabhängig ist, wird bei der Löslichkeit auch immer die Temperatur angegeben, für die diese Löslichkeit gilt. Enthält die Lösung die maximale Menge gelöster Substanz bei einer bestimmten Temperatur, spricht man von einer gesättigten Lösung. Bei weiterer Zugabe der Substanz verbleibt diese ungelöst und setzt sich am Boden ab.
Was versteht man unter Maßlösung, Standardlösung oder Kalibrierlösung?
Eine Lösung mit einem genau bestimmten Gehalt nennt man Maßlösung, Standardlösung oder Kalibrierlösung. Die Bezeichnung Maßlösung wird in der Volumetrie, auch Maßanalyse oder Titrimetrie genannt, verwendet. Bei Maßlösungen bleibt die Konzentration konstant, sie reagieren schnell mit dem Analyten, und die Reaktion läuft vollständig ab. Kalibrier- oder Standardlösungen kommen in der instrumentellen Analytik zum Einsatz. Sie dienen zur Überprüfung oder Justierung von Messgeräten wie pH-Metern oder Leitfähigkeitsmessgeräten.
Herstellen von Maßlösungen
Maßlösungen können aus Urtitersubstanzen hergestellt werden. Urtitersubstanzen sind Reinstsubstanzen, die gut wägbar und unbegrenzt haltbar sind. Sie dürfen sich nicht durch Sauerstoff, Kohlendioxid oder Feuchtigkeit aus der Luft verändern. Eine aus einer Urtitersubstanz hergestellte Maßlösung muss über einen längeren Zeitraum stabil bleiben. Alternativ werden im Laborbedarf auch Konzentrate für Maßlösungen oder gebrauchsfertige Lösungen angeboten.
Zur Volumenmessung von Flüssigkeiten werden im chemischen Labor geeichte Laborbehälter wie Pipetten, Maßkolben, Messbecher und Messzylinder verwendet. Zur Herstellung einer Maßlösung wird die vorher berechnete Substanzmasse auf der Analysenwaage abgewogen und quantitativ in einen Maßkolben überführt. Der Kolben wird bis etwa zu drei Viertel mit dem Lösemittel gefüllt und solange geschwenkt, bis sich die Substanz vollständig aufgelöst hat. Dann wird der Maßkolben vorsichtig bis zur Ringmarke aufgefüllt, verschlossen, und die Lösung wird erneut durchmischt.
Oft ist es im analytischen Labor nicht möglich, eine Lösung mit einem exakten Gehalt herzustellen. Die Abweichung des tatsächlichen von dem theoretischen Gehalt wird durch einen Korrekturfaktor, den Titer genannt, angegeben. Der Titer ist der Quotient aus dem tatsächlichen, experimentell ermittelten und dem theoretischen Gehalt. Das bei einer Titration verbrauchte Volumen an Maßlösung wird mit dem Titer multipliziert. Der Titer von Maßlösungen, die nicht aus Urtitersubstanzen hergestellt werden, muss experimentell mit einer geeigneten Urtitersubstanz bestimmt werden.
Da die Herstellung von Standardlösungen mittels Urtitersubstanzen einige Zeit in Anspruch nimmt, werden im Laborbedarf Ampullen aus Glas oder Kunststoff unter den Handelsnamen Fixanal® oder Titrisol® angeboten, die Konzentrate zur Herstellung vieler gebräuchlicher Maßlösungen enthalten. Die Ampulle wird auf einen Messkolben aufgesetzt, mit einem Glasstab durchstoßen und der Inhalt quantitativ in einen Kolben überführt. Anschließend wird mit destilliertem Wasser bis zur Ringmarke aufgefüllt. Eine Titerbestimmung ist laut Hersteller nicht erforderlich, eine Titerabweichung wird mit ±0,2% angegeben.
Anwendung von Reagenzlösungen
Ein wichtiger Anwendungsbereich von Reagenzlösungen ist die qualitative Analytik. Sie werden zur schnellen Identifizierung von Stoffen eingesetzt. Ein Beispiel ist die Fehling-Probe. Sie dient zum Nachweis von Reduktionsmitteln wie Aldehyde, Hydrazin oder Hydroxylamin und zur Zuckerbestimmung im Harn. Dabei werden Fehlingsche Lösung I, eine verdünnte Kupfersulfatlösung, Fehlingsche Lösung II, eine basische Kalium-Natrium-Tatrat-Tetrahydrat-Lösung und die Probelösung zusammen gegeben. Die zunächst blaue Lösung wird anschließend erwärmt. Bei Anwesenheit von Reduktionsmitteln fällt nach dem Erwärmen rotbraunes Kupfer(I)oxid, Cu2O, aus.
Das Mischungskreuz: Herstellung verdünnter Lösungen
Der Gehalt von konzentrierten und verdünnten Säuren oder Laugen wird oft in Massenprozent angegeben. So enthält konzentrierte Schwefelsäure 96, rauchende Salzsäure 37 und konzentrierte Salpetersäure 65 Massenprozent. Aus diesen Konzentraten können verdünnte Lösungen hergestellt werden.
Zur Berechnung der Volumina verschieden konzentrierter Lösungen, die zum Mischen oder Verdünnen von Lösungen benötigt werden, wird im chemischen Labor das Mischungskreuz verwendet. Links oben stehen die Massenanteile der höher konzentrierten Lösung 1, links unten die der schwächer konzentrierten Lösung 2. In der Mitte werden die Massenprozente der Ziellösung angegeben. Die Anteile an Ausgangslösung 1 ergeben sich aus der Differenz der Massenprozente Ziellösung und Ausgangslösung 2. Entsprechend können die Massenanteile der Ausgangslösung 2 aus der Differenz der Massenprozente der Ausgangslösung 1 und der Ziellösung berechnet werden.
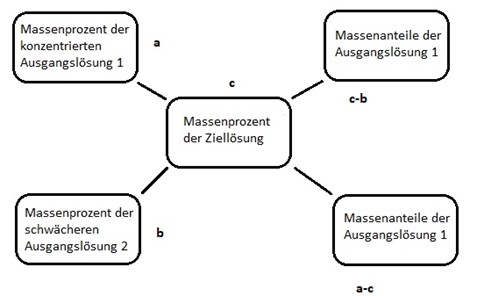
Soll aus konzentrierter Schwefelsäure 10%ige Schwefelsäure durch Verdünnen mit destilliertem Wasser hergestellt werden, beträgt die Konzentration der Ausgangslösung 1 96%, die der Ausgangslösung 2 0% und die der Zielkonzentration 10%. Aus dem Mischungskreuz ergibt sich für die Massenanteile der konzentrierten Schwefelsäure 10 und für die des Wassers 86. Mit 10 g konzentrierter Schwefelsäure und 86 g destilliertem Wasser können 96 g 10%ige Schwefelsäure hergestellt werden.
Eine 10%ige Schwefelsäure-Lösung ist dabei chemisch weniger aggressiv und kompatibel mit einer Vielzahl unterschiedlicher Laborutensilien, beispielsweise Schläuche und Schlauchverbinder aus unterschiedlichen Kunststoffen. 96%ige Schwefelsäure, hingegen, ist äußerst ätzend und korrosiv und nur kompatibel mit chemisch beständigen Werkstoffen wie Glas und fluorierten Kunststoffen wie PTFE (Polytetrafluorethylen).
Werden aus einer Stammlösung mehrere Lösungen verschiedener Konzentration hergestellt, spricht man von einer Verdünnungsreihe. Verdünnungsreihen dienen bei spektroskopischen Methoden wie Atom-Absorptions-Spektrometrie (AAS) oder der optischen Emissionsspektrometrie (OES) dazu, Kalibrierkurven zu erstellen. In einer anschließenden Messung wird eine Probe mit einem unbekannten Gehalt gemessen und aus der Kalibrierkurve deren Gehalt abgelesen.
Da die Volumenabmessung visuell erfolgt, ist sie fehlerbehaftet. Im Laborbedarf werden Dosiergeräte angeboten, die die benötigte Masse der zu lösenden Substanz abwiegen, in das Zielgefäß überführen und so viel Lösemittel zu dosieren, bis die gewählte Konzentration erreicht ist.
Lösungen außerhalb des chemischen Labors
Lösungen spielen nicht nur im chemischen Labor eine wichtige Rolle. Besonders während der Corona-Epidemie waren 70%ige Isopropanol/Wasser-Lösungen gefragte Desinfektionsmittel in Krankenhäusern, Arztpraxen und im Alltag.
Neben Reinigungsmitteln in der Elektronik, Medizintechnik und im Haushalt finden sie auch Anwendung als Nagellackentferner in der Kosmetikbranche. Ethanol als Lösemittel wird auch für die Herstellung flüssiger Medikamente verwendet, da sich die wirksamen Substanzen oft nicht in Wasser lösen. Im Alltag begegnen uns Lösungen in Form von Reinigungsmittel wie Abfluss-, WC- oder Kalkreinigern sowie in alkoholischen Getränken.
Bild-Quellen: Beitragsbild | © H_Ko – stock.adobe.com
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin