Als Kolloidales System oder kurz Kolloid wird die feine Verteilung, auch Dispersion genannt, eines Stoffes in einem anderen, homogenen und kontinuierlichem Medium, dem Dispersionsmedium, bezeichnet. Die Kolloidchemie wurde Mitte des 19. Jahrhunderts von dem italienischen Chemiker und Toxikologen Francesco Selmi (1817 – 1881) und dem schottischen Physikochemiker Thomas Graham (1805 – 1869) begründet. Graham beobachtete, dass manche gelösten Stoffe wie Zucker oder Salze, die sogenannten „Kristalloide“, eine Membran durchdringen konnten, während das bei anderen Stoffen wie Klebern, Gelatine oder Gummi Arabicum unmöglich war. Diese Stoffe nannte er „Kolloide“ – griechisch Kleberartige. Welche besonderen Eigenschaften Kolloide haben und wie sie angewendet werden, stellen wir Ihnen diesem Artikel genauer vor.
Allerdings ist das Vorliegen in kolloidaler Dispersion keine chemische Eigenschaft des Stoffes an sich, denn die verschiedensten Substanzen lassen sich in diese Form bringen, wenn die in der Lösung verteilten Teilchen nur eine bestimmte Größe haben. Diese Größe ist nicht exakt definiert, aber meist wird dafür ein Durchmesser im Nanometer-Bereich angegeben, zwischen ungefähr 1 Nanometer und 1 Mikrometer, also einem Millionstel bis einem Tausendstel eines Millimeters. Ein Bereich, in dem die Teilchen nicht mehr von ihren Quanteneigenschaften, aber in ihren Bewegungseigenschaften noch von der Thermodynamik dominiert werden und die Brownsche Bewegung zeigen.
Allerdings sind auch viele Makromoleküle faserförmig, wie zum Beispiel die DNA oder Polymerketten in Kunststoffen, die zur Herstellung von Schläuchen und Halbzeugen zum Einsatz kommen. Bei Molekülen kleiner als 1 Nanometer spricht man von einer molekularen Lösung. Kolloide können also auch erzeugt werden, indem größere Teilchen in kleinere aufgespalten werden (Dispersion) oder kleinere Moleküle zu größeren zusammengefügt werden (Kondensation).
Auflistung der Arten
Oft werden nur Suspensionen in einer Flüssigkeit als Dispersionsmedium Kolloid genannt, aber bei anderen Definitionen sind auch Suspensionen in Gasen oder Feststoffen eingeschlossen und werden als Kolloid bezeichnet. Wenn sich eine Flüssigkeit in einer anderen fein verteilt, ohne sich in Einzelmoleküle zu lösen, wird dies Emulsion genannt. Damit Emulsionen und Suspensionen in der Pharmazie und Lebensmittelchemie nicht kontaminiert werden, kommen chemisch inerte Elastomerschläuche mit entsprechenden Zulassungen zum Einsatz. Schläuche dieser Art werden auch als Lebensmittelschläuche und Pharmaschläuche bezeichnet.


Hierbei gibt es lyophile Kolloide, bei denen sich das disperse Teilchen mit einer Schicht Lösungsmittel umgibt, wie dies bei Biomolekülen in Wasser, zum Beispiel Gelatine, passiert. Bei lyophoben Kolloiden stoßen sich dagegen Dispersionsmedium und Teilchen ab, die Teilchen bilden kleine Einschlüsse, wie zum Beispiel die Fett-Tröpfchen oder Micellen im wässrigen Medium der Milch oder in umgekehrtem Verhältnis in der Butter. Elektrostatische Abstoßung der dispersen Partikel untereinander und die Wirkung von stabilisierenden Molekülen wie Tensiden verhindern zumindest kurzfristig, dass sich die Micellen zusammenlagern und sich so die Phasen trennen.
Wenn sich eine Flüssigkeit in einem quasi festen Netzwerk aus langkettigen Molekülen dispers verteilt, liegt ein Gel vor – je nach Mischungsverhältnis können aber auch langkettige Moleküle in einer Flüssigkeit Gele bilden. Ein Sol kann sich durch Koagulation in ein Gel umwandeln lassen, und durch diesen Sol-Gel-Prozess lassen sich viele neuartige und hybride Materialien herstellen, zum Beispiel Solarzellen. Auch Verbundwerkstoffe können Kolloide sein.
Ein Gas in einem flüssigen oder festen Dispersionsmedium bildet einen Schaum beziehungsweise Schaumstoff. Bei einem Aerosol verteilen sich flüssige, feste oder komplexe Kleinpartikel in einer gasförmigen Phase, da sie nur langsam absinken. Ein Beispiel für flüssige Aerosole in einer gasförmigen Phase ist Nebel, während Rauch feste Aerosole enthält.

Ein komplexeres Kolloid ist die Eiscreme, in der verschiedene disperse Phasen in einem wässrigen Dispersionsmedium verteilt sind, nämlich Fett-Tröpfchen als Emulsion, Eiskristalle als Gel und Luftbläschen als Schaum.
Kolloide sind oft durch ihre optische Eigenschaften charakterisiert
Wenn die Größe der Teilchen in etwa so groß ist wie die Wellenlänge des einfallenden Lichts ist, bei sichtbarem Licht liegt sie zwischen 400 und 800 Nanometer, wird dieses gestreut. Dieses Phänomen wird nach ihrem Entdecker, dem Naturwissenschaftler und Geodäten John Tyndall (1820 – 1893), Tyndall-Streuung genannt und ist unabhängig von der Wellenlänge des einfallenden Lichts, daher wirken diese Kolloide bei Tageslicht auch weiß, wie Milch oder Nebel.
Bei noch kleineren Partikeln tritt die Rayleigh-Streuung auf, benannt nach dem britischen Physiker Lord Rayleigh (1842 – 1919). Wenn die Teilchen kleiner als die Wellenlänge des Lichts sind, hängt die Wellenlänge des gestreuten Lichts von der Teilchengröße ab. Da größere Teilchen langwelligeres Licht absorbieren, kann ein Kolloid farbig aussehen, selbst wenn die einzelnen Bestandteile farblos sind.
Beispielsweise absorbieren Goldteilchen mit einem Durchmesser von etwa 30 nm das kurzwellige blaue Licht und werfen das langwellige rote Licht zurück, was dem Kolloid eine tiefrote Färbung gibt.

Diesen Effekt findet man auch im Rubinglas, ein festes Sol, das im 17. Jahrhundert eines der ersten synthetischen Kolloide war. Eine Suspension mit etwa 100 nm großen Teilchen absorbiert dagegen das langwelligere rote Licht und erscheint blau. Noch größere Partikel färben die Suspension schwarz und schliesslich verursachen sie keine Färbung der Suspension mehr, ausser wenn sie selbst farbig sind. Dafür sind sie als Teilchen optisch sichtbar, zumindest mithilfe eines Mikroskops.
Chemische Eigenschaften und Anwendungen
Je kleiner die Teilchen sind, in der ein Stoff vorliegt, desto größer ist die Oberfläche für eine bestimmte Menge.
Und je größer die Oberfläche eines Stoffes ist, desto besser kann dieser mit der Umgebung wechselwirken. So werden fein verteilte Medikamente schneller im Körper verteilt und aufgenommen als solche mit kleinerer Oberfläche. Durch Assoziationskolloide, auch als Tenside bekannt, lassen sich fettlösliche Substanzen leichter in Wasser lösen. Diese Eigenschaft der Kolloide wird bei der Wasseraufreinigung sowie bei Wasch- und Reinigungsmitteln genutzt. Auch für die Herstellung fast aller Farben und Lacke sind Kolloide und die Kolloidchemie von Relevanz.

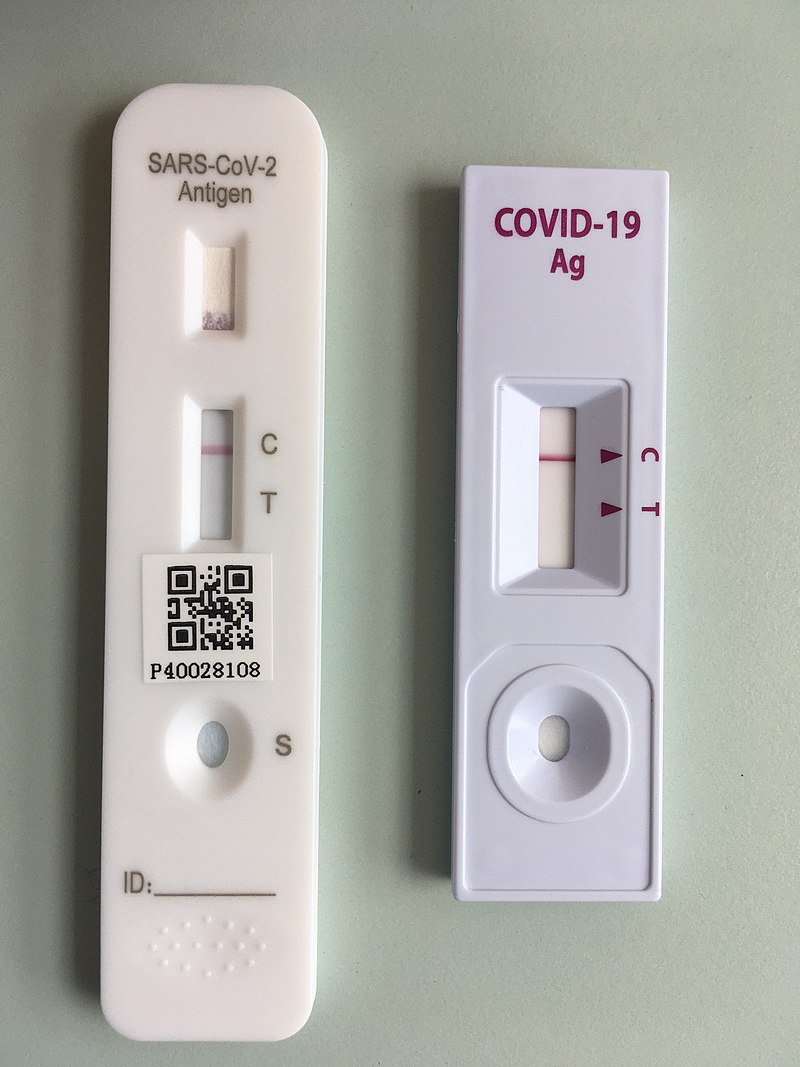
Kolloidales Metall wird in verschiedenen Prozessen eingesetzt, mit denen wir täglich in Berührung kommen, zum Beispiel in der miniaturisierten Mikrochip- und Sensorherstellung. Die rote Farbe des kolloidalen Goldes können viele von uns regelmässig bewundern, denn viele Covid-2-Schnelltests nutzen goldmarkierte Antikörper gegen ein Coronavirus-Antigen. Wenn das Antigen in der Probe vorhanden ist, bindet es der Antikörper und der Komplex bewegt sich, von Kapillarkraft gezogen, solange über den Teststreifen, bis er an einer Bande gebunden und somit eingefangen wird.
Zuerst kommt der Komplex an eine Bande, an der ein zweiter Antikörper gegen das Corona-Antigen immobilisiert ist, und der nur Antigen-Antikörper-Komplexe einfängt. An der zweiten Bande sitzt ein Antikörper, der auch ungebundene Antikörper bindet, und so als Kontrolle dient, dass der Test funktioniert. Wo ein Antikörper bindet, wird das kolloidale Gold als roter Farbniederschlag sichtbar, hoffentlich natürlich nur bei der Kontrollbande.
Wohin wir sehen, überall sind wir also von Kolloiden umgeben – und nicht nur das: auch der Großteil des menschlichen Körpers, nämlich der Inhalt der Zellen, besteht im Grunde aus einer Art Gel.
Quelle: 1) https://www.sigmaaldrich.com/DE/de/technical-documents/technical-article/materials-science-and-engineering/biosensors-and-imaging/gold-nanoparticles
Bildquellen: Beitragsbild | © Peera.P – stock.adobe.com Eiscreme | © Alisa – stock.adobe.com Färbung von kolloidalem Gold | © Aleksandar Kondinski, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=8890972 SARS-CoV-2-Schnelltests | © Lennardywlee, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=98133580
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin