Wie funktioniert das Analyseverfahren?
Büretten sind unverzichtbare Laborgeräte im Bereich der quantitativen Analyse. Im Gegensatz zur qualitativen Analyse, mit der Stoffe in einer unbekannten Probe bestimmt werden, wird bei der quantitativen Analyse die Konzentration, Stoffmenge oder Masse in einer bekannten Substanz bestimmt. Die klassischen Verfahren der quantitativen Analyse sind die Gravimetrie und die Titration, auch Volumetrie, Maßanalyse oder Titrimetrie genannt.
Wie ist eine Bürette aufgebaut?
Büretten werden in der Analyse eingesetzt, um eine Maßlösung zu einer Probelösung zuzugeben.
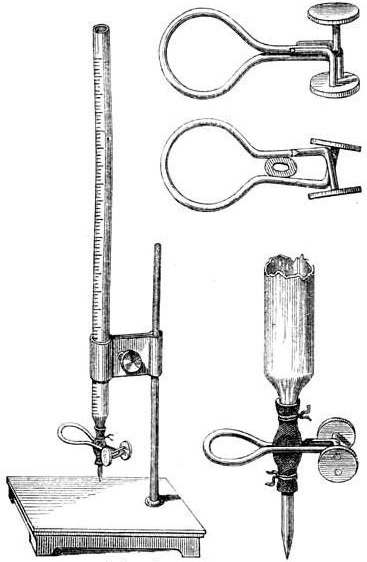
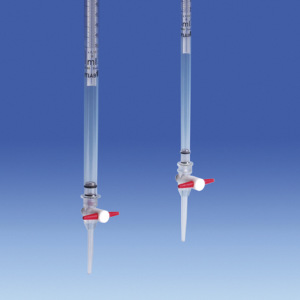
Der Durchfluss wird über eine auf den Schlauch gezogene Metallklammer reguliert, dem Quetschhahn. Im Ausgangszustand drückt die Metallklammer die Schlauchwände zusammen, sodass ein Durchfließen der Maßlösung verhindert wird. Erst durch Betätigung des Quetschhahns wird die Metallklammer geweitet und der Schlauch geöffnet, wodurch der Durchfluss stattfinden kann. Die hier als Quetschhahn bezeichnete Lösung zur Durchfluss-Regulierung ist vom Funktionsprinzip also eher mit einem manuellen Schlauchquetschventil vergleichbar als mit einem Absperrhahn oder Durchgangshahn.
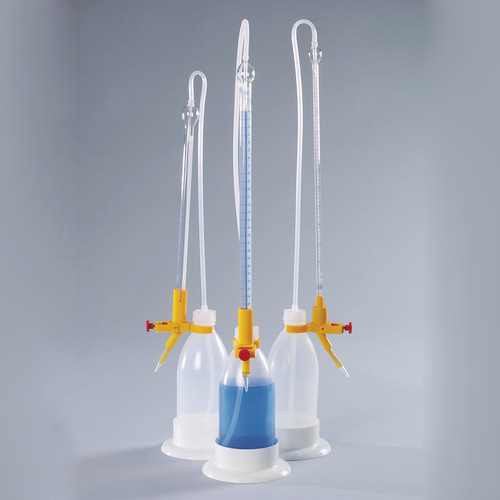
Heutzutage werden manuelle und Flaschenaufsatzbüretten eingesetzt.
Manuelle Büretten
Eine manuelle Bürette besteht aus einem kalibrierten Glasrohr mit Ablasshahn. Die Vorderseite der Bürette ist mit einer Skala versehen, die das Ablesen des Volumens der zugegebenen Maßlösung ermöglicht.
Auf der Rückseite der Bürette ist oft ein sogenannter Schellbachstreifen aufgedruckt, der nach dem deutschen Mathematiker und Physiker Karl Heinrich Schellbach (1805 – 1892) benannt ist. Als Schellbachstreifen bezeichnet man einen breiten weißen Streifen auf der Rückseite einer Bürette, in dessen Mitte sich ein schmaler, meist blauer Längsstreifen befindet. Durch Lichtbrechung an der Flüssigkeitsoberfläche erscheint der blaue Streifen in Form zweier aufeinander gerichteten Pfeilspitzen. An dieser Stelle wird das zugegebene Volumen abgelesen. Mit Hilfe des Schellbachstreifens werden Fehler beim Ablesen des Volumens reduziert.
Büretten bestehen meist aus durchsichtigem Glas, für UV-empfindliche Lösungen wie Silbernitratlösungen werden Büretten aus braunem Glas verwendet.
Flaschenaufsatzbüretten
Eine Flaschenaufsatzbürette wird auf eine Vorratsflasche, die die Maßlösung enthält, montiert. Diese Titrierapparate werden in verschiedenen Ausführungen angeboten.
Titriergeräte nach Schilling
Titriergeräte nach Schilling werden auf eine Polyethylen-Enghalsflasche mit Schlauchdurchführung aufgeschraubt. Beim Zusammendrücken der PE-Flasche wird die Maßlösung durch den Schlauch nach oben in die Bürette gedrückt. Die Titrierapparate werden auch als Schnellbetriebsbüretten nach Schilling bezeichnet.
Titrierapparate nach Pellet
Titrierapparate nach Pellet sind mit einen Normschliff ausgestattet, der auf die Vorratsflasche aufgesetzt wird. Mit Hilfe eines Gummigebläses mit Ventil und Anschlussschlauch wird in der Vorratsflasche ein Überdruck erzeugt. Dadurch wird die Maßlösung über ein seitlich angebrachtes Glasrohr nach oben in die Bürette gedrückt.
Bei beiden Varianten erfolgt die Bestimmung des zugegebenen Volumens der Maßlösung visuell.
Kolbenbüretten
Bei Kolbenbüretten wird die Maßlösung über die Bewegung eines Kolbens dosiert. Durch eine Aufwärtsbewegung des Kolbens wird die Maßlösung aus der Vorratsflasche in den Zylinder gesaugt. Ein Ventil verhindert, dass die Maßlösung in die Vorratsflasche zurückläuft. Durch eine Abwärtsbewegung des Kolbens wird die Maßlösung über eine Titrierkanüle in die Probelösung abgegeben. Die Bewegung des Kolbens erfolgt manuell mit Hilfe eines Handrads oder mit einem Schrittmotor. Das zugegebene Volumen der Maßlösung wird digital angezeigt.
Heute verwenden viele Laboratorien sogenannte Titratoren. Dabei handelt es sich um elektronisch gesteuerte Kolbenbüretten in Kombination mit elektronischen Messgeräten, mit den Titrationen automatisch durchgeführt werden können. Ausgestattet mit PC-Schnittstellen und geeigneter Software werden Titrationskurven, Äquivalenzpunkt und Konzentration der Probelösung berechnet und angezeigt.
Was ist eine Titration?
Die International Union of Pure and Applied Chemistry, abgekürzt IUPAC, definiert die Titration als „Quantitatives Analysenverfahren, in dem eine Probe A mit bekannter Zusammensetzung aber unbekannten Gehaltes mit einem Reagenz B bekannter Konzentration, auch Maßlösung genannt, in
einer chemischen Reaktion mit bekannter Stöchiometrie umgesetzt wird.“[1]
Dabei muss gewährleistet sein, dass der Endpunkt, an dem die Probe A vollständig reagiert hat, erkannt werden kann. An diesem Punkt, den man Äquivalenzpunkt nennt, sind die Stoffmengen in der Probelösung A und in der Maßlösung B äquivalent. Aus dem Volumen und der Stoffmengenkonzentration der zugesetzten Maßlösung B kann die Stoffmenge der Probe A unter Berücksichtigung der Stöchiometrie berechnet werden.
Bestimmung des Äquivalenzpunktes
Ein Indikator ist ein Farbstoff, der den Äquivalenzpunkt durch einen Farbumschlag anzeigt. Da die Bestimmung visuell erfolgt, ist sie ungenauer als die potentiometrische und konduktometrische Bestimmung, bei denen physikalische Messwerte erfasst werden.
Konduktometrie
Bei der Konduktometrie wird die Leitfähigkeit der Lösung in Abhängigkeit von dem Volumen der zugegebenen Maßlösung gemessen. Die Leitfähigkeit der Lösung wird von der Ionenkonzentration bestimmt. Zu Beginn der Titration trägt nur die Ionenkonzentration der Probelösung zur Leitfähigkeit bei. Bei Zugabe der Maßlösung reagieren die Ionen der Probelösung mit den Ionen der Maßlösung. Dadurch nehmen die Ionenkonzentration in der Probelösung ab und damit auch die Leitfähigkeit.
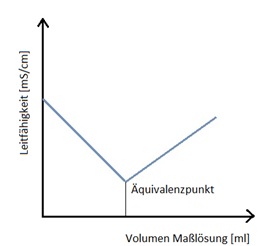
Am Äquivalenzpunkt haben alle Ionen der Probelösung reagiert, die Ionenkonzentration und damit die Leitfähigkeit sind an diesem Punkt am niedrigsten. Wird über den Äquivalenzpunkt hinaus Maßlösung zugegeben, finden deren Ionen keine Reaktionspartner mehr und bleiben in Lösung. Die Ionenkonzentration in der Probelösung steigt wieder an, was ebenfalls zum Anstieg der Leitfähigkeit führt. Die Leitfähigkeit wird nun von den Ionen der zugegeben Maßlösung bestimmt. Der Äquivalenzpunkt kann aus dem Minimum der Leitfähigkeit ermittelt werden.
Potentiometrie
Bei der Potentiometrie wird das Potential zwischen einer Referenzelektrode und einer Messelektrode, die in die Probelösung tauchen, in Abhängigkeit von dem Volumen der zugegebenen Maßlösung gemessen. Die Referenzelektrode, auch als Bezugselektrode bezeichnet, besitzt ein konstantes Potential, unabhängig von der Ionenkonzentration in der Probelösung. Wichtige Bezugselektroden in der Potentiometrie sind die Silber-Silberchlorid-Elektrode und die Kalomel-Elektrode. Das Potential der Messelektrode hängt von der Ionenkonzentration in der Probelösung ab, die sich im Laufe der Titration ändert.
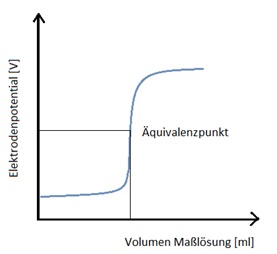
Abhängig von der Titrationsart werden verschiedene Messelektroden eingesetzt. Welche Elektroden für welche Titrationsart verwendet werden, ist in dem Abschnitt Titrationsarten näher erläutert. Bei der Potentiometrie werden die Potentialwerte in Abhängigkeit vom zugegebenen Volumen der Maßlösung gemessen. Aus der Messkurve kann der Äquivalenzpunkt grafisch oder rechnerisch ermittelt werden.
Wie funktioniert eine Titration?
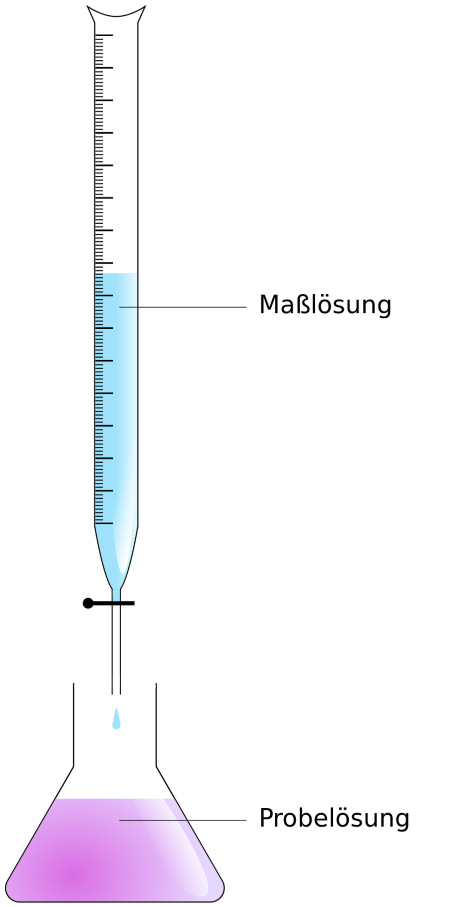
Ein definiertes Volumen der Probelösung wird mit Hilfe einer Pipette in einem Erlenmeyerkolben oder Becherglas vorgelegt. Nach dem Verdünnen mit Wasser werden entweder einige Tropfen Indikatorlösung zugegeben oder geeignete Elektroden in die Probelösung eingetaucht. Die Bürette wird mit der Maßlösung gespült und so ausgerichtet, dass sie senkrecht steht. Dann wird die Maßlösung in die Bürette gefüllt und der Nullpunkt auf der Skala der Bürette exakt eingestellt.
Während die Maßlösung langsam zur Probelösung zugegeben wird, muss diese kontinuierlich bewegt werden. Dies kann manuell durch ständiges Umschwenken des Erlenmeyerkolbens oder mit Hilfe eines Magnetrührers erfolgen. Beginnt sich die Probelösung zu färben oder zeigen die Messwerte eine deutliche Änderung, gibt man die Maßlösung nur noch tropfenweise zu. Ein Farbumschlag beziehungsweise eine deutliche Änderung der Messwerte zeigt das Ende der Titration an. Das Volumen der zugegebenen Maßlösung wird dokumentiert.
Verschiedene Titrationsarten
Je nach chemischer Reaktion unterscheidet man Säure-Base-Titrationen, Fällungstitrationen, komplexometrische und Redox-Titrationen.
Säure-Base-Titrationen
Säure-Base-Titrationen, auch Neutralisationstitrationen genannt, beruhen auf der Reaktion von Hydroxonium-Ionen bzw. Wasserstoffionen, den Protonen, mit Hydroxidionen zu Wasser. Die Stoffmengenbestimmung einer Säure mit der basischen Maßlösung wird als Alkalimetrie bezeichnet. Entsprechend nennt man die Titration einer basischen Probelösung mit einer sauren Maßlösung Acidimetrie.
Anwendungsbeispiele sind die Bestimmung von Phosphorsäure in Cola, der Anteil an Salzsäure im Magensaft, der Säuregehalt von Milchprodukten und die Bestimmung von Zitronensäure und Ascorbinsäure (Vitamin C), die vielen Getränke zugesetzt werden, um Haltbarkeit und Geschmack zu verbessern. Auch die Bestimmung freier Fettsäuren in ungesättigten Ölen und Fetten, die ein Maß für die Frische ist, wird titrimetrisch mit Kaliumhydroxid-Lösung (KOH) bestimmt. Frische Öle besitzen einen niedrigen Anteil an freien Fettsäuren.
Fällungstitrationen
Fällungstitrationen basieren auf der Bildung schwerlöslicher Salze aus Probe- und Maßlösung. Anwendung finden Fällungstitrationen bei der Bestimmung von Chlorid-, Bromid-, Iodid-, Cyanid- und Thiocyanat-Lösungen mit einer Silbernitrat-Maßlösung sowie die Bestimmung von Silber mit einer Natriumchlorid- oder einer Ammoniumthiocyanat-Maßlösung. Diese Fällungstitrationen werden unter der Bezeichnung Argentometrie zusammengefasst werden.

Die Bestimmung des Äquivalenzpunktes erfolgt potentiometrisch mit einer Silberelektrode oder durch Zugabe von Farbindikatoren. Beispiele aus der Praxis sind die Bestimmung von Salz in Butter, der Chloridgehalt in Trinkwasser oder der Silbergehalt in Münzen.
Komplexometrische Titrationen
Komplexometrische Bestimmungen beruhen auf der Bildung von Chelatkomplexen aus Probe- und Maßlösung. Sie dienen der Stoffmengenbestimmung von Metallionen wie Calcium, Magnesium, Kupfer, Blei und Quecksilber. Als Maßlösung werden Komplexbildner wie zum Beispiel Ethylendiamintetraacetat, abgekürzt EDTA, verwendet.
Der Äquivalenzpunkt wird potentiometrisch mit ionensensitiven Elektroden oder durch Zusatz von Metallindikatoren bestimmt. Mit Hilfe komplexometrischer Titrationen wird der Gehalt von Calcium und Magnesium im Trinkwasser bestimmt.
Redox-Titrationen
Bei Redox-Titrationen wird die Probelösung durch die Maßlösung oxidiert oder reduziert, die chemische Reaktion basiert auf einem Austausch von Elektronen. Redox-Titrationen sind beschränkt auf Substanzen, die sich oxidieren oder reduzieren lassen und werden nach der verwendeten Maßlösung benannt.
Die Bestimmung des Äquivalenzpunkts erfolgt durch Zugabe von Redoxindikatoren, Eigenfärbung oder potentiometrisch mit Platinelektroden. Ein Anwendungsbeispiel ist die iodometrische Bestimmung der Iodzahl von Ölen und Fetten, die ein Maß für die Anzahl der ungesättigten Fettsäuren ist. Sie gibt an, wieviel Gramm Iod von 100 g Fett gebunden werden. Dazu gibt man zu einer definierten Menge Fett Iodbromid im Überschuss zu. Das Iodbromid wird an den Doppelbindungen des Fettes addiert. Durch Zugabe von Kaliumiodid zu dieser Lösung reagiert das überschüssige Iodbromid zu Iod. Die Stoffmenge des gebildeten Iods wird mit Natriumthiosulfat-Maßlösung bestimmt. Damit lässt sich die Iodzahl berechnen.
Büretten sind unverzichtbare Helfer im analytischen Labor
Titrationen mit Hilfe von Büretten sind wichtige und schnelle Analyseverfahren in vielen Bereichen. Ob manuelle oder automatische Titration hängt von verschiedenen Faktoren ab. Für die manuelle Titration sprechen die Anschaffungskosten, eine geringe Probenzahl und klare Probelösungen. Sind eine hohe Probezahl, ein geringer personeller und zeitlicher Aufwand, eine gute Reproduzierbarkeit und Rückverfolgbarkeit von Bedeutung, sind automatische Titratoren die bessere Wahl.
Quellen: [1]: IUPAC, A.D. McNaught & A. Wilkinson, Compendium of Chemical Terminology, 2nd edition (the „Gold Book“), Blackwell Scientific Publications, Oxford, 1997
Bildquellen: Beitragsbild | © Anchalee – stock.adobe.com Quetschhahnbürette | © Karl Friedrich Mohr, Joseph Meyer, et al., Public domain, via Wikimedia Commons Vereinfacher Aufbau einer Titration (Titrage.svg) | © User:Liquid 2003derivative work: Matt (Diskussion), CC BY 2.0 <https://creativecommons.org/licenses/by/2.0>, via Wikimedia Commons Indikatoren und ihre Farbskala | © MarkusZi, Public domain, via Wikimedia Commons
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin