Kohlenstoff steht in der zweiten Periode und vierten Hauptgruppe des Periodensystems der Elemente. Mit dieser Position hat es gewissermaßen eine Sonderstellung, denn es kann vier Atombindungen eingehen. Dies ermöglicht eine große Vielzahl an unterschiedlichen Verbindungsmöglichkeiten. Dazu kommt, dass Kohlenstoffatome untereinander Bindungen eingehen können, wodurch die Anzahl der Verknüpfungsmöglichkeiten immens zunimmt. Zwei dieser Möglichkeiten, auch Modifikationen genannt, soll der folgende Artikel näher beleuchten: Die Kohlenstoff-Modifikationen Diamant und Graphit.
Minerale der besonderen Art
Diamant und Graphit sind Modifikationen des Elementes Kohlenstoff, also elementare Stoffe, die nur aus Kohlenstoffatomen bestehen. Nur die Anordnung der Atome in den beiden Modifikationen ist unterschiedlich. Graphit ist ein Mineral, das auf der Erde vergleichsweise häufig vorkommt. Ein Stück Graphit besteht nur aus Kohlenstoffatomen, die über kovalente Bindungen miteinander verknüpft sind. In einer solchen Verbindung, der stärksten aller Bindungsarten, teilen sich die beiden verbundenen Atome die Valenz- oder auch Außenelektronen. Auch der Diamant ist ein Mineral, jedoch weitaus seltener. Genau wie Graphit sind auch im Diamanten die ausschließlich vorkommenden Kohlenstoffatome kovalent untereinander gebunden.

Diamant – der unvergängliche Kohlenstoff?
Im James-Bond-Klassiker „Diamantenfieber“ (1971) überstehen diamantene Schmuckstücke, die von Menschen verschluckt wurden, die Hitze eines Krematoriums. Aber: Schon der berühmte französische Gelehrte Antoine L. Lavoisier (1743 – 1794) verbrannte vor den staunenden Augen der Pariser Zuschauer auf offener Straße einen Diamanten. Er fokussierte mit zwei großen Brenngläsern wie mit einer Lupe die Sonnenstrahlen auf einen in einem Glaskolben befindlichen Diamanten – er verbrannte. Zusätzlich gelang es dem Experimentalchemiker in der von ihm selbst gebauten Apparatur Kohlenstoffdioxid (CO2) als Verbrennungsprodukt nachzuweisen. Dies galt als Beweis dafür, dass Diamanten nur aus Kohlenstoff bestehen.
Der Diamant ist der härteste aller natürlich vorkommenden Stoffe. Diamanten sind farblos und leiten den Strom nicht. Gefunden werden sie unteranderem an teils gefährlichen Orten wie Vulkanschloten – aber warum?

Die dort vorherrschenden Bedingungen wie hohe Drücke und Temperaturen begünstigen die Bildung dieser Modifikation des Kohlenstoffes. Nur ein kleiner Teil dieser Rohdiamanten ist zur Herstellung von Schmuckstücken geeignet. Die meisten finden in Form von Bohrköpfen und Schneidwerkzeugen als Industriediamanten Verwendung. Da bei der Bearbeitung oft hohe Temperaturen auftreten, ist eine Verarbeitung von beispielsweise Stahl mit Diamantwerkzeugen jedoch kaum möglich. Die extremen Bedingungen sorgen für eine Umwandlung von der Modifikation Diamant in Graphit, was unter Umständen eine Diffusion der Kohlenstoffatome und damit eine Verunreinigung des Werkstoffs zur Folge haben kann.
Diamanten lassen sich aber auch künstlich herstellen, indem bei hohem Druck und Temperatur Graphit zusammengepresst wird.
Die Struktur der Diamanten
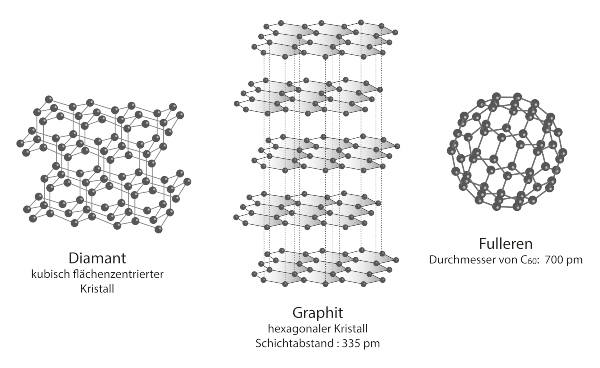
Die Kohlenstoff-Atome im Diamanten bilden ein dreidimensionales Gitter, auch Diamantgitter genannt. Mit seinen vier Valenzelektronen, das sind Elektronen in der äußersten Hülle oder Schale eines Atoms, geht ein Kohlenstoff-Atom vier Elektronenpaarbindungen mit vier anderen Kohlenstoff-Atomen ein. Die so entstehende, tetraedrische Struktur bedingt das Vorkommen gewellter Sechsringe. Vier dieser in diesem Sechsring befindlichen Atome bilden ein ebenes Rechteck, eines der beiden übrig gebliebenen Kohlenstoff-Atome liegt über, das andere unter dieser Ebene. Diese Elektronenpaarbindungen, auch kovalente Bindungen, sind sehr stark, weshalb eine große Energie zur Spaltung aufgebracht werden muss. Dadurch wird unteranderem die besondere Härte des Minerals Diamant erklärt.
Graphit – die häufigste Form des Kohlenstoffs
Die Bleistiftspitze besteht, anders als es der Name vielleicht vermuten lässt, nicht aus Blei, sondern aus Graphit. Graphit ist ein schwarzer, sehr weicher Stoff, der im kristallinen Zustand glänzt. Beim Gleiten über Papier spalten sich kleine Plättchen ab und hinterlassen dabei eine schwarze, leicht silbrig glänzende Spur. Eben wegen dieser Eigenschaft leitet sich die Verwendung des Graphits als Bleistiftmine sowie als Schmiermittel ab. Auch der Name des Graphits selbst, vom griechischen Wort „graphein“, was so viel wie schreiben bedeutet, leitet sich daher ab. Weitere Verwendung findet Graphit zur Herstellung von Elektroden und als Schleifkontakt in Form von Kohlebürsten in Elektromotoren. Denn anders als die Modifikation Diamant ist Graphit aufgrund seiner Struktur in der Lage Strom zu leiten.

Die Struktur des Graphits
Die unterschiedliche Anordnung der Atome in den beiden Modifikationen des Kohlenstoffs sorgt für die teils sehr unterschiedlichen Eigenschaften von Diamant und Graphit. Das Graphitgitter besteht aus übereinander liegenden ebenen Schichten, die sich aus ebenen Sechsringen aus Kohlenstoffatomen zusammensetzen. Je drei Valenzelektronen eines Kohlenstoff-Atoms sind an den Bindungen zu drei weiteren Atomen beteiligt. Das vierte Elektron ist ähnlich dem elektronischen Aufbau von Metallen, in dem die Elektronen im fachsprachlich bezeichneten Elektronengas über die gesamte Struktur verteilt sind, über die ganze Schicht hinweg beweglich. Dieser besondere räumliche Aufbau bedingt, dass Graphit parallel zu diesen Schichten den Strom leiten, horizontal dazu aber als Isolator wirken kann.


Der Abstand zwischen den verschiedenen Schichten ist mehr als doppelt so groß wie zwischen den Atomen in derselben Schicht. Die besondere Weichheit und die Möglichkeit des Einsatzes als Schreib- und Schmiermittel beruht auf der geringen Anziehungskraft zwischen den Schichten, die sehr viel schwächer sind als im Vergleich zu den Kräften zwischen den Atomen innerhalb einer Schicht.
Carbon und andere Werkstoffe aus Kohlenstoff
Die Struktur des Graphits und die damit einhergehenden Eigenschaften dieser Modifikation des Kohlenstoffs ähneln sehr stark den Eigenschaften des im Volksmund bezeichnetet „Carbons“. Gemeint sind dabei aber oftmals Carbonfasern, die durch kontrolliertes Verkohlen von Kunstfasern hergestellt werden und in denen Kohlenstoffatome in Mikrokristallen wie im Graphit angeordnet sind.


Carbonfasern sind fünfmal so zugfest wie Stahl und weitaus korrosionsbeständiger. Sie werden in vielen Bereichen verwendet, in denen die besonderen Eigenschaften dieser Struktur des Kohlenstoffs zum Tragen kommen. Oft werden sie in Kombination mit Kunststoffen verbaut, den carbonfaserverstärkten Kunststoffen (CFK). Diese sind deutlich leichter als Aluminium und werden dort eingesetzt, wo es auf ein geringes Gewicht ankommt, wie im Automobil- und Flugzeugbau. Auch im Hochleistungssport werden in Form von Tennisschlägern, Sprungstäben und Fahrradrahmen carbonfaserverstärkte Kunststoffe eingesetzt.


Weitere Möglichkeiten des Einsatzes von Modifikationen des Kohlenstoffs bestehen in der Verarbeitung von diamantartigem Kohlenstoff durch das Aufbringen einer sehr dünnen Schicht mittels CVD (chemical vapour deposition, dt. chemische Gasphasenabscheidung) auf Bauteilen, um sie vor Verschleiß zu schützen. Das Einbringen von anderen Nicht- und Halbmetallen wie Stickstoff oder Bor in die Diamantstruktur machen Diamanten leitfähig und ermöglichen so den Verbau in Halb- und Supraleitern. Die Kombination der erhöhten Temperaturbeständigkeit und verhältnismäßig freie Beweglichkeit der Elektronen in der Struktur wirken dabei begünstigend. Ein akustischer und weniger optischer Einsatz von Diamanten erfolgt im Preissegment höher anzusiedelnden Tonabnehmern von Langspielplatten (LP), wo sie für die Übertragung des Tons in die Lautsprecher sorgen.
Bildquellen: Beitragsbild | © Björn Wylezich – stock.adobe.com Reiner Graphit | © Ra'ike – de.wikipedia.org Natürliche Diamanten | © Mario Sarto – de.wikipedia.org Kohlenstoff-Modifikationen | © natros – stock.adobe.com Bleistiftspitze aus Graphit | © Helfmann – de.wikipedia.org
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin
