« Qualitäts- und Managementverfahren für chemisch-analytische Methoden und Prozesse »
Fehler können im Arbeitsleben leider niemals ausgeschlossen werden. Wichtig ist es aber, dass gleiche Fehler nicht wiederholt vorkommen. Fehlerbehaftete Mess- und Analysenergebnisse sowie ihre Fehlinterpretation können Folgen haben, die unabsehbar sind. So wurde 1957 das Medikament Contergan als Beruhigungs- und Schlafmittel für Schwangere auf den Markt gebracht. Durch falsche Bewertungen von Ergebnissen bei der Entwicklung des Medikaments blieben Langzeit-Nebenwirkungen des Wirkstoffs Thalidomid unerkannt, deren Folge schwere Missbildungen bei Neugeborenen waren. Allein Deutschland leben Schätzungen zufolge noch heute einige Tausend Contergan-Geschädigte, die oft auf dauerhaft auf medizinische Hilfe angewiesen sind. Um ähnlichen Fehlern wirksam zu begegnen, sind in chemischen und pharmazeutischen Einrichtungen qualitätssichernde Maßnahmen sowie regelmäßige, unabhängige Kontrollen unerlässlich.
Was ist Qualität?
Der Begriff „Qualität“ steht für die Beschaffenheit eines Produktes. Nach der DIN EN ISO 8402 aus dem Jahre 1984 ist Qualität „die Gesamtheit von Merkmalen einer Einheit bezüglich ihrer Eignung, festgelegte und vorausgesetzte Erfordernisse zu erfüllen“. Inzwischen ist die DIN EN ISO 8402 von der DIN EN ISO 9000 abgelöst worden. Die aktuell geltende Version ist die DIN EN ISO 9000:2015-11 – gemäß dieser ist Qualität das Erfüllen von Merkmalen an einer Sache, die sich aus den Anforderungen ergeben. Allen diesen amtlichen Formulierungen entspricht der bereits im Jahre 1974 pragmatisch definierte Qualitätsbegriff des rumänisch-amerikanischen Ingenieurökonomen Joseph Moses Juran (1904 – 2008): „Quality is fitness for use“ – Qualität ist Gebrauchsfähigkeit.

Qualitätsanforderungen im analytischen Labor
Der Begriff „Qualität“ steht gleichermaßen auch für die Richtigkeit von Analysenergebnissen von chemischen Stoffen und Materialien, die für ihre Gebrauchsfähigkeit bestimmten technischen oder stofflichen Anforderungen entsprechen müssen.
Verantwortlich für die Qualität von Analysenergebnissen ist der mit der Untersuchung Betraute. Er muss selbstverständlich ausreichend fachlich qualifiziert, in der praktischen Laborarbeit erfahren und motiviert sein, die Aufgaben verantwortungsvoll und zuverlässig durchzuführen. Um dieses zu erreichen, sind gründliche Einweisungen, eindeutig geschilderte Laborabläufe und Prüfanweisungen notwendig. Ebenso ist auch die Qualität der benötigten Mess- und Prüfmittel festgeschrieben. Zudem müssen Messergebnisse in Prüfprotokollen erfasst und in einer vor Manipulationen und Datenverlust geschützten Labordatenerfassung gesichert werden.
Managementverfahren in der chemischen Analytik
Die für unterschiedliche Unternehmen und Unternehmensbereiche gültige Qualitätsnorm DIN EN ISO 9001 stellt mit ihren Vorgaben an Analyse und Bewertung von Unternehmensstrukturen einen Leitfaden für die Gestaltung und Verbesserung qualitätsrelevanter Prozesse dar.
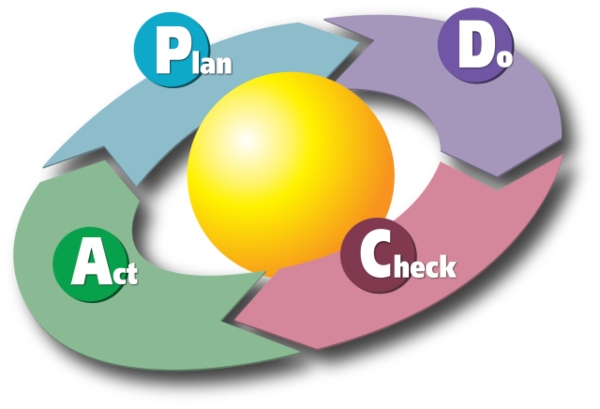
Laborprozesse lassen sich entsprechend dem PDCA-Zyklus optimieren.
Dieser einfache, auf den US-amerikanischen Stistiker William Edwards Deming (1900 – 1993) zurückgehende Algorithmus, der die Planung eines Prozesses (engl. Plan), Durchführung von Tests zur Prozessoptimierung (engl. Do), Ergebnisüberprüfung und -bewertung der Testergebnisse (engl. Check) und schließlich das Erkennen von Verbesserungsmöglichkeiten (engl. Act) umfasst, ist ein fortlaufender, sich wiederholender Kreisprozess, an dessen Ende das iterativ optimierte Ergebnis steht.
An chemische Labore werden darüber hinaus besondere Anforderungen gestellt, um sicherheitsrelevante Analysen zuverlässig und vertrauenswürdig durchführen zu können. Hierfür existieren wichtige und zielorientierte Verfahrensweisen zur Qualitätssicherung im Labor:
- Die „Gute Laborpraxis“ (GLP, engl. Good Laboratory Practice)
- Die Laborakkreditierung gemäß DIN EN ISO 17025
In industriellen Bereichen tritt zu dem vermehrt das „Lean-Management“ hinzu, das sogenannte „schlanke“ Management, das auf optimierte, qualitätswahrende Produktionsprozesse, effiziente Produktionsabläufe zur Kostenminimierung und Maßnahmen zur Ressourcenschonung gerichtet ist.
Die „Gute Laborpraxis (GLP)“
Die „Gute Laborpraxis“ (GLP) wurde in den 1970er Jahren von der US-amerikanischen Food and Drug Administration (FDA) entwickelt und sollte die Zuverlässigkeit und internationale Anerkennung von toxikologischen Medikamentenprüfungen sicherstellen. Heute ist die „Gute Laborpraxis“ in den Grundsätzen der Organisation für Wirtschaftliche Zusammenarbeit und Entwicklung (OECD) definiert und von vielen Staaten eingeführt. Auf Grundlage der europäischen Richtlinien 2004/10/EG und 2004/9/EG ist die GLP auch im deutschen Chemikaliengesetzes (ChemG) verankert und befasst sich gemäß den GLP-Grundsätzen der OECD mit „dem organisatorischen Ablauf und den Rahmenbedingungen, unter denen nicht-klinische gesundheits- und umweltrelevante Sicherheitsprüfungen geplant, durchgeführt und überwacht werden“.

Unternehmen, die Chemikalien, Medikamente oder Lebensmittel in den Verkehr bringen, sind daher verpflichtet, nach dem aktuellen Stand der GLP-Grundsätze zu arbeiten. Dieses gilt auch für Prüfungen zur Registrierung von Chemikalien gemäß der EU-Chemikalienverordnung REACH. Diese Verpflichtung soll sicherstellen, dass die bei Sicherheitsprüfungen erzeugten Daten nachvollziehbar, richtig und lückenlos dokumentiert sind. Hierfür fordert die GLP neben ausreichenden Räumlichkeiten, Personalressourcen und unabhängigen Verantwortlichkeiten das streng formale System der „GLP-Prüfeinrichtung“ für die Qualitätssicherung im Labor, wie das nachstehende Schema verdeutlicht:
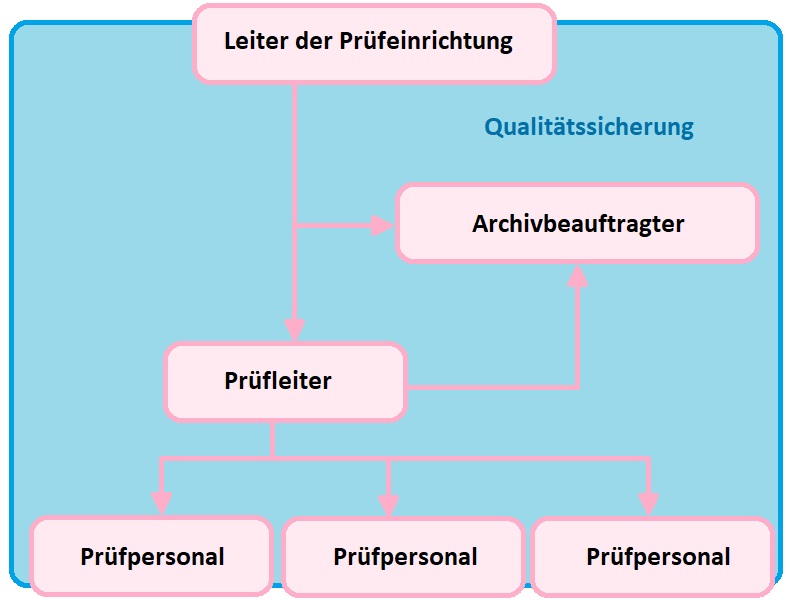
Im Rahmen dieser GLP-Prüfeinrichtung führt qualifiziertes Laborpersonal zum Beispiel Untersuchungen an Arzneistoffen durch und weist die Zuverlässigkeit ihrer Prüfergebnisse in schriftlichen Aufzeichnungen nach. Alle Prüfungen und Aufzeichnungen werden zudem durch eine zweite Person nach dem Mehraugenprinzip überwacht. Der Prüfleiter ist verantwortlich für die Planung aller erforderlichen Prüfungen, deren Umsetzung und die abschließende Berichterstellung. Zudem überwacht eine unabhängige Qualitätssicherung die GLP-konforme Durchführung aller Prüfungen und ein Archivbeauftragter stellt sicher, dass alle Prüfmuster, Proben und Daten langfristig und sicher aufbewahrt werden.


Entsprechend dem Leitsatz „Was nicht dokumentiert ist, ist nicht getan“ ist in der GLP-Prüfdokumentation nachzuweisen, wer, was, wann, wie und womit gemacht hat. Hierfür müssen alle Organisationsstrukturen, Laborabläufe und durchzuführende Tätigkeiten in Standard-Arbeitsanweisungen (SOP, engl. Standard Operation Procedures) eindeutig und allgemeinverständlich beschrieben sein.
Die Laborakkreditierung gemäß ISO 17025
Die Laborakkreditierung ist ein Managementverfahren für Prüf-Labore, die qualitativ hochwertige und zuverlässige Prüfdienstleistungen für Dritte auf ihrem speziellen Fachgebiet anbieten wollen. Als internationale Referenz für die Anerkennung ihrer Fachkompetenz soll sie das Vertrauen in mögliche Auftraggeber steigern. Hierfür legt die aktuelle Version der DIN EN ISO/IEC 17025 entsprechende Qualitätsstandards fest und deckt hierbei auch alle wichtigen technischen Entwicklungen und IT-Techniken im Bereich der elektronischen Datenerfassung und Datenspeicherung sowie der Berichterstellung ab. Anhand der in der Norm gestellten Anforderungen sollen die Kompetenz und die Qualität von Prüfungen in einem chemischen Labor kontinuierlich gesteigert und darüber hinaus zuverlässige und mit anderen Laboren vergleichbare Ergebnisse erzielt werden. Ein interessierter Kunde soll die Frage „Würde ich dem Labor einen Auftrag geben?“ positiv beantworten wollen.


Eine Laborakkreditierung bezieht sich immer auf bestimmte Prüfmethoden oder Kalibrierungen, die ein fachbezogenes Labor durchführen kann, zum Beispiel Materialprüfungen nach anerkannten Normverfahren oder chemische Analysen nach laboreigenen Methoden. Für die Anerkennung müssen sich Analysen- und Kalibrierlabore regelmäßig durch qualifizierte Fachleute einer national benannten und branchenbezogenen Akkreditierungsstelle, durch Prüfer, überwachen lassen.


Die Prüfprozesse in einem akkreditierten Labor müssen derart aufgebaut und dokumentiert sein, dass ein Nachweis der Rückführbarkeit aller Prüfergebnisse auf nationale oder internationale Referenznormale möglich ist. Hierbei muss eine sinnvolle Abschätzung der vorhandenen Messgenauigkeiten mit Hilfe statistischer Methoden durchgeführt werden und die erhaltenen Messtoleranzen in umfassenden Prüfberichten ausgewiesen werden. Die Anforderungen an die Prüfung und Kalibrierung der eingesetzten Laboreinrichtungen ist daher strenger als in der „Gute Laborpraxis“.

So müssen Geräte, wie Waagen, bei zweifelhaften Ergebnissen außer Betrieb gesetzt, gekennzeichnet und an einer festgelegten Stelle verwahrt werden, bis diese repariert, geprüft oder neu kalibriert sind. Dabei ist der Nachweis ihrer fehlerfreien Funktionalität zu erbringen. Zu den notwendigen regelmäßigen Prüfungen der Laboreinrichtungen gehört, wie auch in der GLP, die Protokollierung der erforderlichen Rahmenbedingungen, wie der Umgebungstemperatur und der Luftfeuchtigkeit. Ohne diese Qualifizierung können Abweichungen gegebenenfalls nicht erkannt werden, wodurch erhebliche Fehler bei Prüfergebnissen möglich sind.
Verfahren zur Bewertung von Messverfahren
Analysen- und Prüfmethoden werden mit Hilfe einer Methodenvalidierung bewertet. Sie dient dem Nachweis, dass ein Prüfverfahren zuverlässige Ergebnisse entsprechend der festgelegten Qualitätsmerkmale liefert. Ein Qualitätsmerkmal kann zum Beispiel die Messabweichung in Prozent von einem theoretischen oder „wahren“ Messwert sein. Hierfür ist es notwendig, die Messtoleranzen der eingesetzten Geräte und Messmittel zu kennen. Messmittel im chemischen Labor können zum Beispiel Waagen oder volumetrische Geräte, wie Büretten oder Messpipetten, sein.
Die theoretisch und anhand von Messungen ermittelten Genauigkeiten müssen in einem zweiten Schritt an realen Proben überprüft werden.
Hierbei können auch mögliche Einflüsse von Probenbestandteilen festgestellt werden, wie Änderungen der Menisken mit der Folge von Ablesefehlern an Pipetten und Büretten, weil sich die Benetzung des Glases geändert hat. Um solche Einflüsse festzustellen, werden Proben mit dem zu prüfenden Stoff versetzt oder aufgestockt.
Wichtige und regelmäßig zu überwachende Validierungsparameter sind:
- Die Präzision als Maß für die Streuung von Messergebnissen. Diese wird mit Hilfe von Mehrfachmessungen bestimmt.
- Die Richtigkeit, welche systematische Messabweichungen beschreibt und durch Aufstockung einer Probe bestimmt werden kann.
- Die Robustheit als Fähigkeit auch unter anderen Rahmenbedingungen noch stabile und zuverlässige Ergebnisse liefern zu können, zum Beispiel mit anderen Analysengeräten, Chemikalien oder abweichenden Umgebungstemperaturen.
Anhand der ermittelten Validierungsergebnisse erfolgen abschließend eine statistische Fehlerabschätzung und die Bestimmung des Gesamtfehlers eines Messverfahrens.
Bildquellen: Beitragsbild | © angellodeco – stock.adobe.com Diagramm des PDCA-Zyklus | © Karn-b - Karn Bulsuk – commons.wikimedia.org Prüfung und Kalibrierung von Laboreinrichtungen | © Unique Vision – stock.adobe.com
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin
