Wenn es darum geht, Flüssigkeitstransfers von großen Mengen von Proben mit extrem geringen Volumina im Mikro- bis Nanoliter-Bereich durchzuführen, ist ein menschlicher Operator oft schnell ebenso überfordert wie gelangweilt. In einem modernen Labor kann die Automatisierung von diesen Arbeitsschritten der Synthese und Analytik dabei helfen, den Kopf für das Denken freizuhalten.
Die ersten als Laborautomatisierung bezeichneten Systeme gab es in den 1970er Jahren in der Verfahrenstechnik, um chemische Synthese-Prozesse zu regeln. Die mit einem Computer verbundenen Reaktoren besaßen Thermostate, Pumpen, Ventile und Geräte, um Mischungs-Prozesse zu steuern und Parameter wie pH-Wert und Temperatur zu messen und zu regeln. Automatische Maschinen, die menschliche Tätigkeiten direkt ersetzen, daher auch als Roboter bezeichnet, kamen Anfang der 1980er in den ersten voll-automatischen Laborsystemen zum Einsatz, um in japanischen Kliniken eine große Menge von Patienten-Proben zu analysieren[1].
Seit dem Jahr 2000 erhöhen die Omics-Revolution und die fortschreitende Quantifizierung und Charakterisierung von biologischen Molekülen den Bedarf an der Analyse von Gen- und Protein-Proben massiv. Seitdem sind Methoden wie Gen-Sequenzierung, Protein-Strukturanalyse, Proteomik, Microarrays und Hochdurchsatzscreening (engl. High-Throughput-Screening) in den Vordergrund gerückt.

Oft geht es darum, eine große Zahl unterschiedlicher Biomoleküle, wie etwa Nukleinsäuren oder Peptide, sowie niedermolekulare Stoffe mithilfe der kombinatorischen Chemie zu synthetisieren, wozu ebenfalls automatisierte Labortechnik zum Einsatz kommt. Im folgenden Schritt müssen diese Molekül-Bibliotheken, die Millionen Substanzen enthalten können, auf ihren biologischen oder pharmakologischen Effekt untersucht werden, und im High-Throughput-Screening sind dafür Laborautomatisierung und Automated Liquid Handling unverzichtbar geworden.
Methoden der Laborautomatisierung: das Liquid Handling
Das Automated Liquid Handling umfasst verschiedene Prozesse der Laborautomatisierung, wie das Befüllen, Abgeben, Mischen und den Transport von Flüssigkeit sowie auch Methoden der Detektion, wobei oft ein Mikrotiterplatten-Format verwendet wird. Da sich Tropfen im Mikro- und Nanoliter-Bereich nur schwer von alleine vom Flüssigkeitsfilm ablösen, muss bei der Ablösung aktiv nachgeholfen werden, wofür unterschiedliche Methoden zum Einsatz kommen.
Zum einen Air-Displacement-Systeme, Inkjet-Systeme und Pin-Tools, letztere ähnlich einem Nadeldrucker.
Flüssigkeitstransfer mit Air-Displacement Systemen
Von Hand bediente Pipetten und Spritzen werden schon seit Jahrhunderten in der Chemie, Biologie und Medizin eingesetzt, um Flüssigkeiten dosiert und kontrolliert abzugeben. Seit dem Mittelalter gibt es die Spritze (engl. Syringe). Dies ist eine Pumpe, bei der die Flüssigkeit direkt durch Kolbenhub durch die Düse eingesaugt und durch Druck wieder abgegeben wird, die also nach dem Direkt-Verdränger-Prinzip arbeitet. Dieses Flüssigkeitstransfer-System ist auch für zähe Flüssigkeiten und organische Lösemittel geeignet. In der Laborautomatisierung der chemischen Synthese und Analytik werden daher oft Spritzenpumpen in der Form einer Micro-Syringe für den Mikroliterbereich eingesetzt.
Bei einer Pipette wird die Flüssigkeit durch das Vakuum eines durch Kolbenhub erzeugten Luftpolsters (engl. Air Displacement) angesaugt. Pipetten wurden zuerst im 18. Jahrhundert von Francois Descroizilles (1771 – 1825) beschrieben und erhielten ihren Namen durch den Physiker Joseph-Louis Gay-Lussac (1778 – 1850). Die seit Langem weitverbreiteten Tropf- oder Pasteur-Pipetten, benannt nach dem Chemiker und Mikrobiologen Louis Pasteur (1822 – 1895), sind gezogene Glas- oder Plastikpipetten mit mehreren Millimetern Durchmesser.

Bei den frühen Pipetten diente meist der Mund des Operators zur Erzeugung des Unterdrucks, aber mit wachsendem Bewusstsein für Arbeitssicherheit setzten sich mechanische und elektrische Pipettierhilfen durch. Da insbesondere die Life Sciences erforderten, geringere Volumina präzise, reproduzierbar und steril zu pipettieren, begannen seit Mitte des 20. Jahrhunderts von Hand bediente Mikroliterpipetten zu dominieren[2]. Die gängigsten Formen sind die Konstruktionen von Marburg/Eppendorf® mit einem festgelegten Volumen, und von Gilson® mit einem verstellbaren Volumen. Da die meisten Pipetten im modernen Labor-System abwerfbare Einweg-Pipettenspitzen verwenden, kommen sie selbst nicht mehr in direkten Kontakt mit der Lösung. Dies schützt vor Kreuz-Kontamination, was insbesondere beim Arbeiten mit Nukleinsäuren essentiell ist. Mehrkanalpipetten erlauben Pipettieren von mehreren Proben beziehungsweise Samples in einem Schritt, insbesondere in Kombination mit Mikrotiterplatten, die seit den 1980er Jahren weite Verbreitung finden.
Im automatisierten Labor werden Spritzenpumpen und Pipetten besonders für Arbeits-Volumen im Mikroliter-Bereich und größer verwendet, wie zum Beispiel für Wasch-Schritte. Zudem sind sie technisch weniger aufwändig als die Inkjet-Systeme, und mit passendem Pumpen- und Schlauchsystem lassen sie sich auch leichter zu einem selbst konstruierten Automated Liquid Handling System kombinieren.
Non-Contact-Dispensing mit Piezo- und Inkjet-Systemen
Wenn die analysierten Substanzen wertvoll oder rar sind, und damit im stärker minaturisierten Maßstab gescreent oder gefertigt werden soll, wie etwa bei der Herstellung von Mikroarrays, müssen die pipettierbaren Volumina noch kleiner sein, nämlich im Nano- bis Picoliter-Bereich. Wenn die pipettierten Volumina extrem klein sind oder extrem viele Proben pipettiert werden müssen, ist der Flüssigkeitstransfer von Hand fast unmöglich, daher wird für solche Anwendungen automatisches Liquid Handling eingesetzt.


Bei der Non-Contact Dispensing-Method findet der Flüssigkeitstransfer ohne Kontakt zwischen Dispenser und Ziel-Behälter statt. Davon sind die meisten Formen Inkjet-Verfahren. Das bedeutet, Tropfen werden wie bei einem Tintenstrahldrucker durch verschiedene Arten von Impulsen aus einer Kapillare ausgestoßen – oft werden bei dieser Form des Liquid Handling dafür sogar normale Tintenstrahl-Drucker eingesetzt. Beim Solenoid Dispensing wird ein elektromagnetisch gesteuertes Ventil geöffnet, um die unter Druck stehende Flüssigkeit ausströmen zu lassen.
Beim Thermal-Inkjet wird ein Teil der Flüssigkeit verdampft, dabei bildet sich eine Gasblase, und wenn diese platzt, wird ein Tröpfchen ausgestossen. Obwohl dafür die Flüssigkeit bis zum Sieden erhitzt werden muss, wurde selbst für viele biologische Probemoleküle ein Verlust der Aktivität nur im Bereich von wenigen Prozent gemessen.
Der Piezoelektrische Inkjet verwendet einen piezoelektrischen Kristall, der beim Anlegen einer Spannung seine Form ändert und so die Flüssigkeit aus einer Kapillare drückt. Bei der akustischen Droplet Ejection wird Flüssigkeit in einem Reservoir zum Schwingen gebracht, sodass sich an einer Stelle ein Tropfen bildet, der schliesslich nach oben hin abgeschossen wird. Je höher die akustische Frequenz, desto kleiner der Tropfen.

Ein Vorteil der Nano-Dispenser-Methoden ist neben geringem Probenvolumen, dass der Transfer kontaktfrei ist, der Ziel-Behälter und dessen Inhalt also nicht berührt werden, und somit kein Risiko einer Verschleppung der Reagenzien besteht. Die Tropfengröße der beschriebenen Nanodispensing-Methoden ist klein, aber auch größere Volumina können transferiert werden, indem Tröpfchen wiederholt (bis zu 500 Mal pro Sekunde) ausgestoßen werden.
Laborautomatisierung durch Pipettier-Roboter
Ein Vorteil von robotischen Workstations ist, dass diese längere Zeit ohne Ermüdung akkurat und reproduzierbar arbeiten können. Der einfachste Pipettier-Roboter besteht im Wesentlichen aus einer motorisierten Pipette, die eine bestimmte Menge an Flüssigkeit einsaugt und ausstößt. Bei einem kartesischen Roboter sind die verschiedenen Geräte, zum Beispiel der Dispenser, so aufgehängt, dass sie durch Bewegung in den drei Raum-Achsen Flüssigkeitstransfer vom einen zum anderen Ort durchführen können. Andere Roboter sind in ihrer Beweglichkeit vergleichbar mit einem menschlichen Arm, manche können sogar das gleiche Instrumente und Gerät benutzen wie ein menschlicher Operator.
In modularen Systemen können Liquid Handling Roboter mit Geräten wie Zentrifugen, PCR-Maschinen und analytischen Geräten wie Multiwell-Platten-Readern kombiniert werden.
Dank Liquid Handling können so komplexere Arbeitsabläufe ausgeführt werden, wie die Manipulation und Mischung der Proben, und der Proben-Transport zu anderen Modulen. Andere Roboter werden speziell für bestimmte Anwendungen konstruiert, beispielsweise für die Hämatologie oder Immunohistochemie in klinischen Labors. Eine spezielle Form der Laborautomatisierung ist das sogenannte Lab on a Chip, bei dem verschiedene Funktionen eines Labors durch die Kombination eines mikrofabrizierten elektro-mechanischen Systems mit aktiven Komponenten wie Dosier- und Schlauchsystemen übernommen werden.
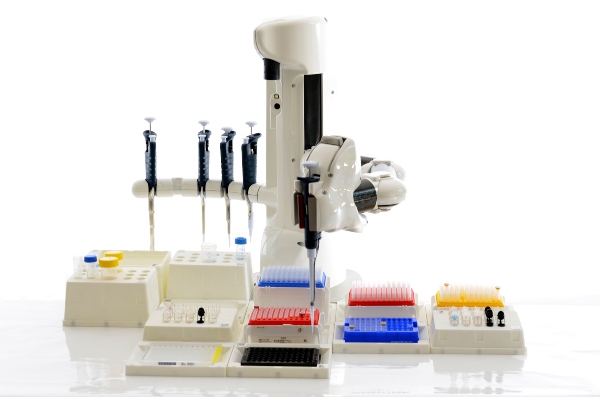
Schon jetzt gibt im Labor freibewegliche Roboter für das Liquid Handling, die mithilfe von künstlicher Intelligenz Experimente zur Optimierung von chemischen Verfahren nicht nur manuell ausführen, sondern auch selbständig planen und mit auftretenden Problemen, wie etwa verstopften Schläuchen und defekten Pipetten, umgehen können[3]. Wenn der Roboter zeitaufwändige Routine- und Optimierungs-Arbeiten auch in der Labor-Organisation übernimmt, und die Mensch-Maschine-Schnittstelle gut funktioniert, haben die menschlichen Wissenschaftler dank der Lab on a Chip-Technologie hoffentlich mehr Zeit zum kreativen Denken.
Quellen: 1) Sasaki M. et al (1998): Total laboratory automation in Japan. Past, present, and the future. https://europepmc.org/article/med/10023829 2) Kong F. et al. (2012): Automatic Liquid Handling for Life Science: A Critical Review of the Current State of the Art https://journals.sagepub.com/doi/10.1177/2211068211435302 3) Burger B. et al. (2020): A mobile robotic scientist https://www.nature.com/articles/s41586-020-2442-2
Bildquellen: Beitragsbild | © warut – stock.adobe.com Labor-Roboter für das Liquid Handling | © Pzucchel, CC BY-SA 3.0 <https://creativecommons.org/licenses/by-sa/3.0>, via Wikimedia Commons
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin
