Wie entsteht Krebs, welche Proteine steuern den Alterungsprozess oder wie schaffen es Bakterien, sogar den Kunststoff PET abzubauen, wie eine japanische Forschergruppe im US-Fachmagazin „Science“ im Jahr 2016 berichtete?[1] An diesen und anderen Fragen arbeiten Forscher aus verschiedenen Fachbereichen wie der Zellbiologie, Genetik oder Biochemie tagein und tagaus im Labor. Am Anfang ihrer Untersuchungen stehen, je nach Fragestellung, tierisches Gewebe, Pflanzenmaterial oder eine Bakterienkultur, aus der sie ein ganz bestimmtes Protein oder genetisches Material isolieren und weiter charakterisieren möchten. Für den ersten Schritt, das möglichst schonende Aufbrechen von Gewebe und Zellen, um an deren Inhalt zu gelangen, steht der Biochemie ein ganzer Methodenbaukasten zur Verfügung.
Eine gute Vorbereitung ist wichtig
Zellgewebe und Zellen sind komplexe Gebilde, die aus vielen verschiedenen Zellorganellen und einer mehr oder weniger stabilen Zellwand aufgebaut sind. Aus diesem Gemisch soll nur ein ganz bestimmter Teil, beispielsweise der Zellkern, ein einzelnes Protein oder die genomische DNA isoliert werden. Dafür müssen die Zellen aufgebrochen, das heißt die schützende Zellwand zerstört werden, um die darin enthaltenen Zellbestandteile frei zu setzen.
Dies muss unter möglichst schonenden Bedingungen passieren, denn sie sollen im Labor auch außerhalb der Zelle ihre Funktion behalten und nicht inaktiviert werden.
Das Material bestimmt die Methode
Bakterien, Pflanzenzellen oder tierisches Gewebe sind unterschiedlich robust gegenüber äußeren Einflüssen, weshalb sich für das Labor verschiedene Möglichkeiten für den Zellaufschluss etabliert haben. So reicht es manchmal schon aus, die Probe mit destilliertem Wasser zu versetzen, um die Zellen zum Platzen zu bringen und so ihre inneren Bestandteile durch vorsichtiges Rühren in Lösung zu halten, in anderen Fällen werden mechanische Aufschlussverfahren und ein Homogenisieren der Probe notwendig.

Mit sanften Methoden ans Ziel
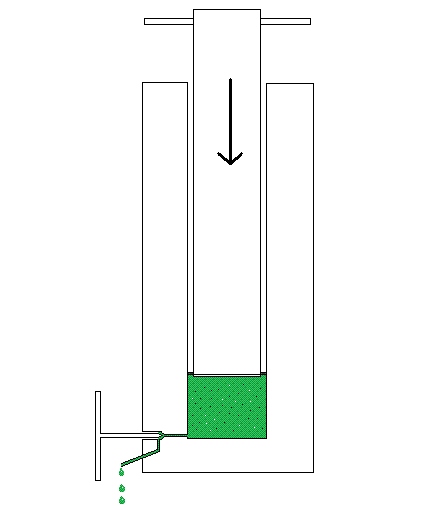
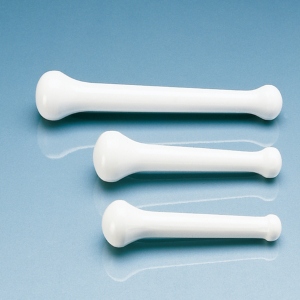
Bei sehr fragilen Zellen, beispielsweise Leukozyten, reichen bereits sehr geringe mechanische Kräfte aus, man spricht dabei von Scherkräften, wie sie durch Rühren oder wiederholtes Pipettieren der Zellsuspension entstehen, um sie aufzuschließen. Etwas stabilere, tierische Zellen können mit einem sogenannten „Dounce-Homogenisator“ aufgeschlossen werden, den der US-amerikanische Biochemiker Alexander L. Dounce (1909 – 1997) im Jahre 1954 für die Isolierung von Zellinhalten eingeführt hatte. Dabei handelt es sich um ein zylindrisches Glasgefäß mit einem lose eingeschliffenen Pistill, der das Zerreiben des Zellmaterials zwischen Pistill und der Zylinderinnenfläche ermöglicht. Diese Methode ist sehr sanft und zerstört die Zellorganellen nicht.

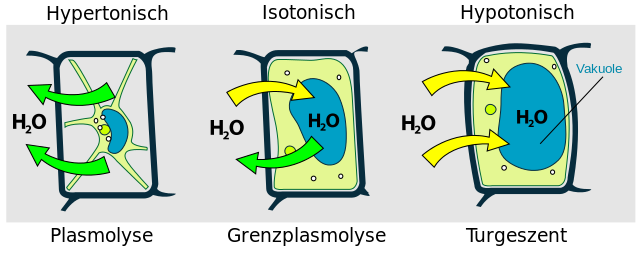
Statt durch Rühren äußere Scherkräfte zu erzeugen, können Zellen, die wie Leukozyten keine Zellwand besitzen, durch Osmose lysiert werden. Bringt man die Zellen in einen Laborbehälter mit einem hypotonischen Medium, beispielsweise destilliertem Wasser, passiert folgendes: da die Ionenstärke innerhalb der Zelle größer ist als außen, dringt Wasser von außen in die Zelle und bringt sie durch den im Inneren entstehenden Druck zum Platzen. Auch Bakterien und Hefen können im Labor durch Osmolyse aufgeschlossen werden, wenn diese zuvor mit einem Zellwand abbauenden Enzym, beispielsweise Lysozym, behandelt wurden.


Das umgekehrte Prinzip, die Entwässerung von Zellen durch hypertonische Medien, wird in der Praxis mit kalten, wassermischbaren organischen Lösungsmitteln, beispielsweise mit Aceton, realisiert. Durch Rühren mit kaltem Aceton lösen sich die Lipide aus der Zellmembran und werden auf diese Weise schonend extrahiert.
Eine sehr einfach durchzuführende Methode, die ohne Homogenisieren, zusätzliche Lösungsmittel oder sonstigen Laborbedarf auskommt, ist das wiederholte Einfrieren und Auftauen von Zellen. Da sich Wasser beim Gefrieren ausdehnt, wird die Zellmembran zerstört und der Zellinhalt freigesetzt.
Schwierigere Fälle brauchen spezielle Methoden
Bestimmte Gewebetypen, wie Pflanzengewebe oder tierisches Muskelgewebe, müssen vor dem eigentlichen Zellaufschluss vorbehandelt werden. Mit Schere oder Skalpell wird das Gewebe zunächst grob zerschnitten und anschließend durch Rühren mit einem Homogenisator weiter zerkleinert. Diese Rührgeräte arbeiten mit schnell rotierenden Messern, die das Zellgewebe homogenisieren.
Nicht immer ist ein Homogenisator notwendig, auch mit Mörser und Pistill oder einem speziellen Rührstäbchen können pflanzliche Zellwände durch festes Rühren und Zerreiben zerstört werden, ebenso wie Bakterien und Hefen. Durch Mischen mit Glasperlen, Korund oder Seesand als Abrasionsmittel wird der Aufschluss erleichtert. Vibrationszellmühlen arbeiten nach dem gleichen Prinzip: hier werden Bakterienzellen mit Glasperlen, meist Mikroglasperlen mit Durchmessern zwischen 50 und 500 µm, in speziellen Laborbehältern aus Edelstahl oder Kunststoffen, wie Polyvinylidenfluorid (PVDF), vermischt und danach kräftig geschüttelt.

Sehr schnell und effizient können Zellen durch Ultraschall aufgeschlossen werden. Hierfür werden „Ultraschall-Stabschwinger“ eingesetzt, stabförmige Ultraschallgeneratoren, die unmittelbar in die Zellsuspension eingetaucht werden. Sie arbeiten gewöhnlich im Frequenzbereich zwischen 25 bis 40 kHz und bewirken sehr schnelle und starke Druckschwankungen. Die Zellen werden dadurch extremen Scherkräften ausgesetzt und zerstört.
Auch die „French-Press“, eine auf den US-amerikanischen Biochemiker Charles S. French (1907 – 1995) zurückgehende Methode für den Aufschluss von Bakterienkulturen, nutzt das Auftreten von Scherkräften.
Die Zellsuspension wird dazu aus einem zylindrischen, stabilen Laborbehälter unter hohem Druck durch eine Kanüle mit einem Durchmesser von unter einem Millimeter gepresst. Die dabei auftretenden Scherkräfte führen zu Rissen in der Zellmembran und damit zum Aufbrechen der Zellen.
Das Milieu bestimmt den Erfolg…
In der intakten zellulären Matrix befinden sich die Proteine und alle anderen Zellbestandteile in einer Umgebung, in der sie ihre Funktion bestens erfüllen können. Ionenstärke sowie pH-Wert in der Zelle stimmen und die Zellwand schützt vor äußeren Einflüssen. Werden im Labor jedoch die Zellwände durch Homogenisieren zerstört, ändern sich die physiologischen Bedingungen schlagartig, wodurch die zuvor geschützten Zellbestandteile inaktiviert, denaturiert oder degradiert werden können. Für die späteren Untersuchungen ist es jedoch unbedingt notwendig, sie in ihrer aktiven Form zu halten.

Als Basis dazu dienen Pufferlösungen, zum Beispiel Phosphatpuffer. Durch den Zusatz von neutralen Salzen, üblich sind Natrium- oder Calciumchlorid, wird die Ionenstärke den physiologischen Bedingungen angepasst. Mit dem Zellaufschluss werden aber auch proteinabbauende Enzyme, sogenannte Proteasen, freigesetzt, die sofort beginnen, die vorhandenen Proteine abzubauen. Beigemischte Protease-Inhibitoren, sogenannte Proteasehemmer, verhindern den Proteinabbau. Außerdem werden Reduktionsmittel, wie Mercaptoethanol, zugesetzt, um Oxidationsprozesse zu minimieren. Weiterhin werden Chelatbildner, beispielsweise Ethylendiamintetraacetat (EDTA), hinzugefügt, um mögliche Schwermetallionen zu komplexieren, die sich an aktive Enzymzentren binden und deren Funktion inhibieren können.

Durch Zugabe von nichtionischen Tensiden wird verhindert, dass Proteine in der Lösung aggregieren und ausfallen. Bewährt hat sich dafür Triton® X-100, ein wasserlöslicher Polyoxyethylen-Octylphenylether.
Schließlich muss bei jedem Zellaufschluss die Temperatur beachtet werden. Schon beim Zerkleinern und Rühren im Homogenisator kann sie sehr schnell ansteigen.
Werden beispielsweise Proteine zu hohen Temperaturen ausgesetzt, verlieren sie ihre natürliche Faltung – ihre Konformation – und denaturieren. Praktisch begegnet das jedem, der ein Ei kocht und damit das Eiweiß denaturiert. Deshalb wird ein Zellaufschluss im Labor immer unter externer Kühlung oder in einem Eisbad durchgeführt.
In professionellen Rührgeräten, Zellmühlen oder Homogenisatoren sind Kühlsysteme meist standardmäßig verbaut.
Auf den Zellaufschluss folgen weitere Schritte…
Ob nun mechanische Methoden für den Zellaufschluss gewählt werden, wie das Homogenisieren oder die Ultraschallbehandlung, oder nichtmechanische Verfahrensweisen, wie der enzymatische Aufschluss mit Lysozym oder das wiederholte Einfrieren und Auftauen der Zellsuspension, ist vom Ausgangsmaterial abhängig. In jedem Fall folgt nach dem bereits sehr aufwändigen Aufschluss des biologischen Materials die sorgfältige Abtrennung von unerwünschten, mit abgetrennten Zellbestandteilen durch Extraktion, Zentrifugation oder durch chromatographische Verfahren. Erst danach können die eigentlichen Untersuchungen des empfindlichen biologischen Materials erfolgen.
Quelle: [1]: Science Vol. 351, March 2016, pp 1196 – 1199
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin