« Das muss gefeiert werden! »
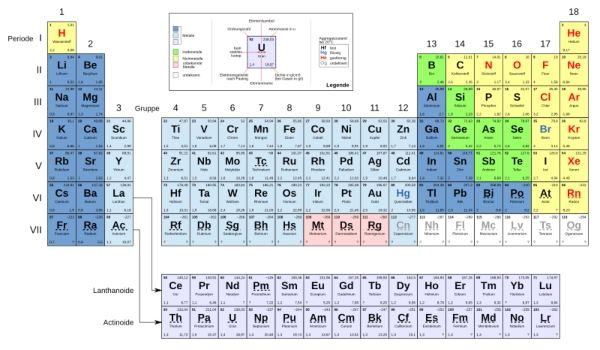
Vor genau 150 Jahren entdeckte der St. Petersburger Professor der Chemie Dmitri I. Mendelejew (1834 – 1907) eine von der Natur vorgegebene Systematik, die zu einer Periodizität der chemischen Elemente führt. Zu seiner Zeit waren 63 natürlich vorkommende Elemente identifiziert und benannt, jedoch blieb deren Anordnung und der große Zusammenhang dieser kleinsten Teilchen ein Rätsel. Parallel eiferten Chemiker auf der ganzen Welt das Geheimnis zu lüften, bis dann 1869 Mendelejew und kurze Zeit später der deutsche Chemiker Lothar Meyer (1830 – 1895) in Göttingen auf die verblüffende Laune der Natur aufmerksam wurden. Sortierte man die Elemente nach ihrem Atomgewicht, schien es, als würden sich chemisch-physikalische Eigenschaften alle 7 innerhalb einer kleinen Periode und alle 17 Elemente innerhalb einer großen Periode wiederholen. Diese Entdeckung in eine Tabellenform gebracht und das Periodensystem der Elemente (PSE) war geboren.

Besonders beeindruckend ist dabei, dass weder atomare Strukturen noch Elektronen zu dieser Zeit bekannt waren. Trotzdem gelang es Mendelejew, Vorhersagen zu fehlenden Elementen des Periodensystems sowie zu ihren Eigenschaften und dem Reaktionsverhalten zu treffen. Dies brachte ihm letztendlich auch den Ruhm als Entdecker des Periodensystems ein. Seit der ersten Fassung vor 150 Jahren hat sich in diesem System einiges verändert. Das Periodensystem umfasst nun 118 Elemente, von denen 90 natürlich vorkommen und 28 künstlich durch Kernfusion erzeugt wurden.
Die Entdeckung der Edelgase und die Anordnung nach Kernladungszahlen ließen die Periodizität auf 8 und 18 Elemente ansteigen. In einer langen Form des PSE sind nun sogar in der sechsten und siebten Gruppe 32 Spalten abgedruckt.
Zum ersten Mal in der Geschichte des Periodensystems sind keine Lücken mehr vorhanden. Mit etwas Wehmut könnte man meinen, die Arbeit sei getan und die Ordnung vollständig benannt. Aktuell umfasst die Ordnung, die in sieben Perioden unterteilt ist, 118 Elementgruppen. Wissenschaftler sind sich jedoch sicher, dass diese Erfolgsgeschichte weiterzuschreiben nur eine Frage der Zeit sein kann. Denn solange im Atomkern die Anziehungskraft die abstoßende Coulomb-Kraft überwiegt, scheint der Synthese weiterer, schwerer Elemente keine Grenze gesetzt.
Vertrauen ist gut, doch Kontrolle ist besser…
Das Periodensystem der Elemente fehlt in keinem Schul- und Lehrbuch. Doch wer überwacht und koordiniert das ordnungsgemäße Einfügen neuer Elemente? Im Jahre 1919 wurde die International Union of Pure and Applied Chemistry (IUPAC) gegründet, welche sich seither mit der möglichst einheitlichen und systematischen Namensgebung chemischer Substanzen beschäftigt. Auch das Periodensystem der Elemente fällt in den Aufgabenbereich der IUPAC. Von dem Erstellen der Anforderungen zur Entdeckung eines neuen chemischen Elementes, über die Regularien zur Namensgebung, bis hin zu dem Erstellen der neusten Versionen des PSE, die IUPAC ist dafür der Ansprechpartner.


Die Entdeckung der vorerst letzten vier Elemente mit den Ordnungszahlen 113, 115, 117 und 118 wurde 2016 von der IUPAC bestätigt. Die Namen dieser jüngsten Mitglieder des PSE könnten abwechslungsreicher nicht sein: Nihonium (Nh), Moscovium (Mc), Tenness (Ts) und Oganesson (Og). Aber damit nicht genug, auch andere Elemente tragen bedeutungsvolle Namen. Das Element Phosphor ist nach dem griechischen „phosphoros“ (φώσφορος = Lichtträger) benannt und spiegelt so die Eigenschaft des weißen Phosphors wider, im Dunkeln zu leuchten. Der Name des Halogens Brom (Br), hergeleitet vom altgriechischen Wort „bromos“ (βρωμος = Gestank), beschreibt die stechend riechenden Bromdämpfe. Das radioaktive Schwermetall Neptunium (Np) wurde nach dem Planeten Neptun benannt.
Wie rund 30 andere Elemente des Periodensystems wurde das Element 110, das 1994 bei der Gesellschaft für Schwerionenforschung in Darmstadt erstmalig synthetisiert worden war, nach seinem Entstehungsort benannt: Darmstadtium. Es ist das einzige Element, welches in dieser Ordnung den Namen einer deutschen Stadt trägt. Der Kreativität sind jedoch auch Grenzen gesetzt. Eine Petition, das Element Moscovium (Mc), nach dem verstorbenen Frontsänger der Band Motörhead, Lemmy Kilmister, doch „Lemmium“ zu nennen, wurde abgelehnt.

Unter dem Motto „Ordnung ist das ganze Leben“
Das Periodensystem der Elemente als großes Ordnungssystem enthält alle (Atom-)Grundbausteine des Lebens. Die darin einsortierten chemischen Elemente, insbesondere die leichteren, wie Wasserstoff (H), Kohlenstoff (C), Stickstoff (N), Sauerstoff (O), Phosphor (P) und Schwefel (S), machen über 99 % der Biomasse auf der Erde aus. Der Ordnung und den Gesetzen der Chemie und Physik folgend, formen organische Verbindungen sämtliche Lebewesen, vom Bakterium über die Pflanzen und Tierwelt bis zum Menschen.
Jeder lebende Organismus besteht vornehmlich aus Kohlenstoff-Verbindungen, die in ihrer Form und Funktion unterschiedlicher nicht sein könnten. Dabei entstehen vor allem Bindungen zwischen Elementen, die sich durch Aufwenden der Bindungsenergie reversibel verhalten und chemische Reaktionen ermöglichen. In der menschlichen Ernährung dienen die Makronährstoffe, Kohlenhydrate (bestehend aus C, H und O), Proteine (hauptsächlich bestehend aus C, H, O und N) und Fette (bestehend aus C, H, O, N und P), nach ihrer Aufnahme durch kontrollierte Abbaureaktionen der Energiegewinnung. Die entstehenden Bruchstücke dieser Verbindungen werden für die Synthese benötigter Bio-Moleküle verwendet. So entsteht ein Recycling-Kreislauf der chemischen Elemente.


In solch einem gezielten Auf- und Abbau finden sowohl reaktionsträge Edelgase, wie Neon (Ne) oder Argon (Ar), als auch Edelmetalle, wie Gold (Au) oder Platin (Pt), keine biologisch sinnvolle Verwendung. Ebenso verhält es sich mit Elementen, die sehr starke Bindungen mit anderen Elementen eingehen, wie Siliciumdioxid (SiO2), geformt aus Silicium (Si) und Sauerstoff (O). Diese Verbindung macht einen Großteil der Sandvorkommen aus. Trotzdem ist elementares Silicium aufgrund der hohen Bindungsenergie aus SiO2 nicht leicht zugänglich.


Die Ionen der Mineralstoffe Natrium (Na), Magnesium (Mg), Chlor (Cl), Kalium (K) und Calcium (Ca) hingegen übernehmen im menschlichen Körper eine Vielzahl lebensnotwendiger Funktionen. Der Aufbau des Membranpotentials durch unterschiedliche Verteilung positiv und negativ geladener Ionen über die Membran dient der Signalweiterleitung des Nervensystems und stellt eine dieser Funktionen dar.
Ebenso von immenser Wichtigkeit, wenn auch nur in sehr geringen Mengen im menschlichen Körper vertreten, sind Spurenelemente wie Eisen (Fe), Kupfer (Cu), Zink (Zn) und Iod (I). Iod und die anderen Spurenelemente bilden Komplexe mit organischen Verbindungen und sichern die Funktionalität verschiedener Enzyme, Hormone und Vitamine. In dem roten Blutfarbstoff Hämoglobin ist es Eisen, das die Sauerstoffaufnahme in der Lunge, den Transport über die Blutbahn und die Sauerstoff Abgabe im Zielgewebe leistet. Diese beeindruckend vielfältigen Aufgaben der Elemente verdeutlichen die Bedeutsamkeit ihrer Entdeckung und des näheren Verständnisses ihres Aufbaus.
Gedruckt auf T-Shirts oder Tassen
Die United Nations Educational, Scientific and Cultural Organization (UNESCO) erklärte das Jahr 2019 zum internationalen Jahr des Periodensystems der Elemente. Ziel der Feierlichkeiten „150 Jahre Periodensystem“ ist es, neben den wissenschaftlichen und technologischen Aspekten die globale Aufmerksamkeit auf die Errungenschaften der Chemie zu lenken. Für den Chemiker und Naturwissenschaftler bedarf es für die Ehrung des Periodensystems kein besonderes Jahr, das allerorts zum Jubiläum auf Kalendern, Postern, Tassen und T-Shirts präsentiert wird. Er hat das PSE stets präsent vor seinem geistigen Auge, mit dem sich ihm die wunderbare Welt der Chemie erschließt, um sie der Menschheit dienstbar machen zu können.
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin
