Kalkablagerungen auf verchromten oder Edelstahl-Armaturen und blinde Fliesen im Bad sehen unschön aus. In Heißwasserbereitern, in der Kaffeemaschine oder in Rohrleitungen führen sie jedoch zu Problemen, denn sie mindern die Wärmeübertragung und behindern den Durchfluss des Wassers. Doch Kalk ist nicht gleich Kalk.
Als Baustoff ist er unverzichtbar. Forstbetriebe lassen über Wälder großflächig Kalk ausbreiten, um der Versauerung der Waldböden entgegenzuwirken – und der Kleingärtner tut es ebenso. Aus Marmor wurden schon in der Antike Paläste und Tempel gebaut und Skulpturen gemeißelt, die uns noch heute faszinieren, wie auch die bizarren Gebilde in Tropfsteinhöhlen, Stalaktiten und Stalagmiten, die die Natur über Jahrtausende im Verborgenen aus Kalk geformt hat. Und auch das Weltklima wird durch Kalk und seinen Kreislauf in der Natur wesentlich mit beeinflusst. Ob er erwünscht ist oder nicht, der Naturstoff Kalk begegnet uns ständig und überall und spielt für unser Dasein eine gewichtige Rolle.

Was Kalk ist und wo ist er zu finden?
Kalk ist Calciumcarbonat (CaCO3), das Calcium-Salz der Kohlensäure (H2CO3), die es eigentlich in dieser Form gar nicht gibt, denn sie ist nicht beständig und zerfällt zu Wasser und Kohlenstoffdioxid (CO2). Doch sie bildet stabile Salze, die chemische Stoffklasse der Carbonate. Kalk ist in der Natur in vielerlei Gestalt und Form verbreitet. Der größte Anteil ist als Kalkstein im Wasser vorzufinden, Meeresablagerungen, an deren Bildung unter anderem Muscheln und Korallen beteiligt waren.
Tektonische Ereignisse haben im Verlauf der Erdgeschichte die Meeresböden der Erde angehoben, aus denen schließlich ganze Gebirgszüge, wie in Europa das Wettersteingebirge oder die Dolomiten in den Kalkalpen, hervorgegangen sind.
Marmor ist eine besonders schöne Form von Kalkgestein, er ist kristallin und hat sich nachträglich aus Kalkstein-Ablagerungen in der Tiefe der Erdrinde bei hohen Temperaturen und hohem Druck gebildet. Von Mineralogen werden solche über Jahrmillionen ablaufende Prozesse als „metamorphe Umwandlungen“ bezeichnet.

Zur Stoffklasse der „natürlichen“ Carbonate zählen auch Kaliumcarbonat (K2CO3) mit dem historisch begründeten Trivialnamen „Pottasche“ und Natriumcarbonat (Na2CO3), das besser als „Soda“ bekannt ist. Sie und mancherorts auch Kalk sind Bestandteile von Salzlagerstätten, die einst beim Verdunsten von frühen Meeren entstanden sind.
Unliebsamer Kalk und der Härtegrad des Wassers
Die grauen, stumpfen Ablagerungen an der Duschwand und am verchromten Wasserhahn sind jedem schon begegnet. Der Grund dafür ist im Wasser gelöster Kalk, der, wie einst beim Austrocknen der Urmeere, zurückbleibt, wenn das Wasser verdunstet.
Je nachdem, wie kalkhaltig das Wasser ist, wird zwischen „hartem“ und „weichem“ Wasser unterschieden, was anhand der unterschiedlichen Schaumentwicklung mit Seife beobachtet werden kann.
Starke Schaumbildung bedeutet weiches, kalkarmes Wasser, geringe Schaumbildung hingegen weist auf hartes, stark kalkhaltiges Wasser hin. Denn in Wasser gelöster Kalk bildet mit Seifen, das sind Natrium- oder Kaliumsalze langkettiger Carbonsäuren, schwer lösliche Calcium-Salze, die „Kalkseifen“. Dadurch sind die gut wasserlöslichen Natrium- oder Kalium-Seifen für die Schaumbildung und für die damit verbundene Waschwirkung nicht mehr verfügbar, vielmehr sind Kalkseifen auch Bestandteile der unliebsamen Kalkablagerungen im Bad.


Die Wasserhärte hängt selbstverständlich von der Herkunft des Wassers ab. Gebirgswasser enthält mehr Mineralstoffe (bspw. Kalium und Calcium) und damit auch mehr Kalk und ist härter, als das aus Uferfiltraten der Flüsse gewonnene Trinkwasser. In Deutschland ist die Härte eines Wassers als Calciumoxid-Gehalt (CaO) in Millimol Calciumoxid pro Liter Wasser definiert und in „Grad deutscher Härte“ (°dH) angegeben.

Danach ist Wasser mit einem Calciumoxid-Gehalt bis zu 1,3 mmol/l, dem eine Wasserhärte bis zu 7 °dH entspricht, ein „weiches“ Wasser. Wasser mit einem Calciumoxidgehalt von mehr als 2,5 mmol/l ist hingegen „hartes“ Wasser, dem eine Härte über 14 °dH entspricht. Als eine besser überschaubare Faustregel gilt: Ein Grad Deutscher Wasserhärte (1 °dH) entsprechen 10 mg Calciumoxid im Liter Wasser. Doch die vielen Zahlen dürften nur die wenigsten interessieren: Der Laie erfühlt die Wasserhärte beim Wäschewaschen und Duschen oder erkennt sie an den Kesselsteinablagerungen im Wasserkocher.
Wo kommt der Kalk her? – der Kohlenstoffkreislauf
Kalk ist wegen seines im Carbonat enthaltenden Kohlenstoffes Teil des geologischen Kohlenstoffkreislaufs in der unbelebten Natur und als Naturstoff einer von vielen Kohlenstoffspeichern. Mit einem vergleichsweise geringen Vorkommen von 0,03 % auf unserer Erde ist Kohlenstoff dennoch ein klimatisch sehr entscheidendes Element. Dabei sind 99 % der Masse des gesamten Kohlenstoffes zum großen Teil in Sedimenten fixiert, wie in Carbonaten und somit auch im Naturstoff Kalk.
Bei der Verwitterung von Kalkgestein wandelt in Wasser gelöstes CO2 aus der Luft, beispielsweise Regenwasser, das unlösliche Calciumcarbonat CaCO3 in lösliches Calcium-Hydrogencarbonat Ca(HCO3)2 um.
Hierdurch wird Calciumcarbonat aus dem Gestein mobilisiert und mit dem Wasser fortgetragen. Durch solche Auswaschungen gelangt Kalk auch in unser Trinkwasser, wo er schlussendlich auch für die die Wasserhärte verantwortlich ist. Unter veränderten äußeren Bedingungen, wie andere Temperaturen, kann die Rückreaktion des Hydrocarbonats unmittelbar zu Kohlenstoffdioxid und Calciumcarbonat erfolgen, wobei sich letzteres dann als Feststoff ablagert.


Als Hydrocarbonat findet Kalk schließlich auch über die Flüsse seinen Weg bis in die Meere. Mikroorganismen, Muscheln und Korallen bilden daraus ihre Außenskelette, die sich nach dem Absterben als Carbonat-Sediment am Meeresboden absetzen.
Erhöht sich der Kohlenstoffdioxid-Anteil in der Atmosphäre, steigt auch die CO2-Konzentration in den Weltmeeren.
Es löst sich folglich darin auch mehr Kohlenstoffdioxid und Meere beginnen zu „versauern“. Die Folgen für die Meeresflora und -fauna sind weitreichend, weil sie dann nicht mehr zur Kalkbildung für den Aufbau ihrer Skelette imstande sind. Prognosen besagen, dass sich der pH-Wert, der im Normalmittel bei pH = 8,25 liegt, bis zum Ende des Jahrhunderts auf 7,5 absenken wird, wenn hier nicht global gegengesteuert und der anthropogene CO₂-Ausstoß erheblich verringert wird.


Baukalk – Kalk als Baustoff
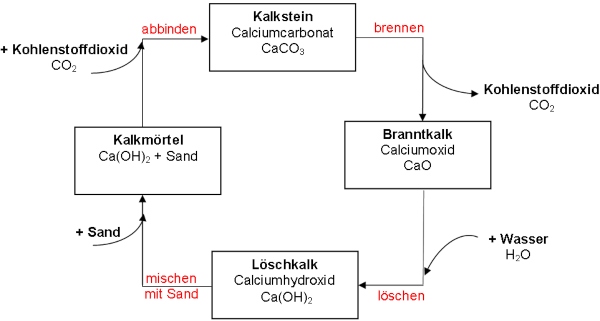
Kalk ist als Baustoff, ebenso wie Marmor, bereits seit der Antike bekannt. Während Marmor vergleichsweise einfach mit Muskelkraft, Hammer und Meißel abgebaut und unmittelbar verwendet werden kann, ist der Kalkstein so, wie er vorgefunden wird, als Baumaterial nicht besonders gut geeignet. Er ist porös und dadurch weniger fest und würde besonders in unseren Breiten schnell der Verwitterung anheimfallen. Um aus natürlichem Kalkstein (CaCO3) einen Bauststoff zu gewinnen, muss er in die geeignete chemische Form gebracht werden. Das erfolgt in einem zweistufigen Umwandlungsprozess, dem „Kalkbrennen“ und dem nachfolgenden „Kalklöschen“.
Der in Steinbrüchen abgebaute und gemahlene Kalkstein CaCO3 wird zunächst bei etwa +1000 °C in ofenähnlichen Anlagen geglüht, man sagt „gebrannt“, wobei er sich zu Kohlenstoffdioxid und Calciumoxid (CaO) umsetzt, dem „Branntkalk“:
Kalkbrennen: CaCO3 → CaO + CO2
Branntkalk reagiert mit Wasser exotherm, also unter starker Wärmeentwicklung, zu Calciumhydroxid Ca(OH)2, dem stark alkalischen „Löschkalk“:
Kalklöschen: CaO + H2O → Ca(OH)2
Wird Löschkalk mit Sand gemischt, erhält man Kalkmörtel. Beim Abbinden setzt sich der Löschkalk mit Kohlenstoffdioxid aus der Luft wieder zu festem Kalkstein um, zu Calciumcarbonat (CaCO3):
Abbinden: Ca(OH)2 + CO2 → CaCO3 + H2O
Dabei bildet Calciumcarbonat feinkristalline Strukturen aus, die mit kantigem Bruchsand ein festes Gefüge ergeben und dadurch das Gemäuer zusammenhält. Heute wird Kalkmörtel vorwiegend für den Innenausbau von Gebäuden und, meist mit weiteren Zuschlagstoffen, als Außenputz verwendet.
Überall und nirgends
Kalk ist allgegenwärtig, als lästige Ablagerungen im Bad und als mineralischer Bestandteil im Trinkwasser, der die Wasserhärte bestimmt. Doch in der freien Natur lernen wir seine wahre Schönheit kennen, als Kalkgebirge, die sich im Laufe von Millionen Jahren aus den frühen Meeren erhoben haben, und in Tropfsteinhöhlen und Grotten. Als Baustoff ist Kalk seit der Antike bekannt, als edler Marmor, als Kalkstein und als gebrannter Kalk für Bauten, die uns immer noch hohen Respekt abverlangen. Auch heute kann im Bauwesen auf Kalk nicht verzichtet werden. Doch seine wichtigste Funktion erfüllt Kalk als Teil des anorganischen Kohlenstoffkreislaufs, der für das Klima dieser Welt so wichtig ist.
Der Naturstoff Kalk ist ein Alleskönner, der in vielen alltäglichen Bereichen und in der Natur seine sichtbaren und auch unsichtbaren Rollen spielt.
Bildquellen: Beitragsbild | © Angela Staenicke – stock.adobe.com David von Michelangelo | © Rico Heil (User:Silmaril) – de.wikipedia.org Kalkablagerungen am Absperrventil | © Richard Huber – commons.wikimedia.org Technischer Kalkkreislauf | © H. Hoffmeister – de.wikipedia.org
 Reichelt Chemietechnik Magazin
Reichelt Chemietechnik Magazin
